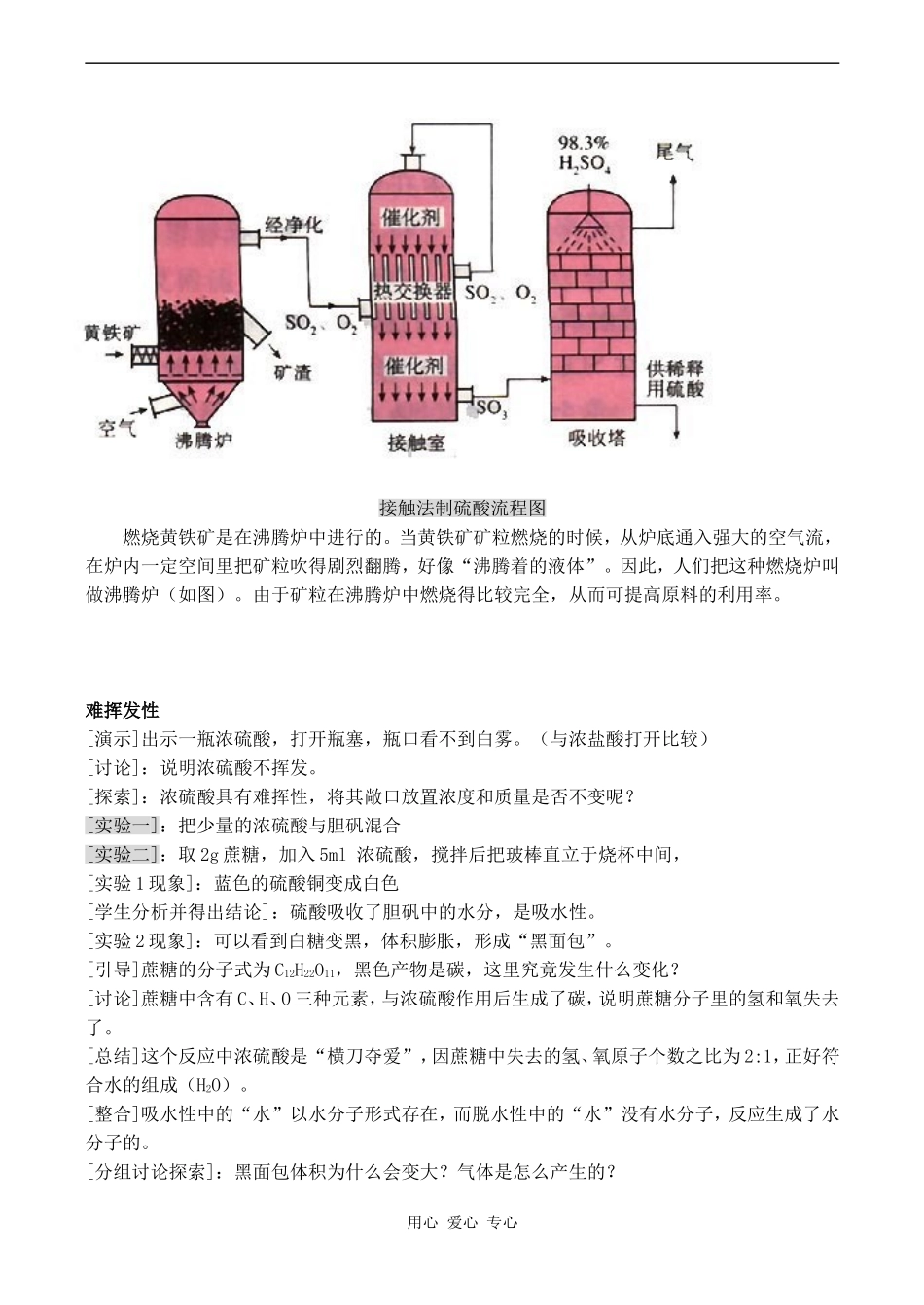
硫酸的制备和性质【教学目标】(1)知识目标:掌握浓硫酸的特性,尤其是浓硫酸的强氧化性。(2)能力目标:培养学生的观察能力、探索能力、创造能力。(3)哲学目标:理解量变引起质变的规律。树立辩证唯物主义世界观。【教学重点】浓硫酸的化学性质和硫酸根离子的检验。【教学难点】浓硫酸的强氧化性。【教学过程】历史上硫酸是如何被人发现的据我国科学家考证,在公元650~683年(唐高宗时),炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》卷九中就记载着“炼石胆取精华法”,即干馏石胆(胆矾)而获得硫酸。若用化学方程式表示则为:CuSO4·5H2OCuSO4+5H2O;CuSO4CuO+SO3;SO3+H2OH2SO4,这一发现比西方早五六百年。孤刚子不仅用这种硫酸分解过金矿,而且还发现了硫酸参与的许多惊奇的变化,如他知道稀硫酸对铜不能腐蚀的性质。8世纪阿拉伯炼金家贾比尔发现,将硝石和绿矾一起蒸馏,所得气体溶于水得硫酸。后来人们还发现某些矿泉中有浓厚的硫磺味道,可治疗皮肤病,这是因为河水长期接触硫铁矿(FeS2)等,被缓慢氧化成微量H2SO4,使河水味道发酸。这个变化可表示为:2FeS2+7O2+2H2O2H2SO4+2FeSO4至于用硫磺燃烧(通过铅室法)制硫酸,则是17世纪以后的事,而用接触法制硫酸则更是19世纪以后才出现的。一:硫酸稀硫酸的性质:-----酸通性(1)与指示剂作用变色(2)硫酸+金属硫酸盐+氢气(表现H+的氧化性)(3)硫酸+碱性氧化物硫酸盐+水(4)硫酸+碱硫酸盐(碱不足则硫酸氢盐)+水(5)硫酸+盐硫酸盐+新酸(弱酸或挥发性酸)用心爱心专心接触法制硫酸流程图燃烧黄铁矿是在沸腾炉中进行的。当黄铁矿矿粒燃烧的时候,从炉底通入强大的空气流,在炉内一定空间里把矿粒吹得剧烈翻腾,好像“沸腾着的液体”。因此,人们把这种燃烧炉叫做沸腾炉(如图)。由于矿粒在沸腾炉中燃烧得比较完全,从而可提高原料的利用率。难挥发性[演示]出示一瓶浓硫酸,打开瓶塞,瓶口看不到白雾。(与浓盐酸打开比较)[讨论]:说明浓硫酸不挥发。[探索]:浓硫酸具有难挥性,将其敞口放置浓度和质量是否不变呢?[实验一]:把少量的浓硫酸与胆矾混合[实验二]:取2g蔗糖,加入5ml浓硫酸,搅拌后把玻棒直立于烧杯中间,[实验1现象]:蓝色的硫酸铜变成白色[学生分析并得出结论]:硫酸吸收了胆矾中的水分,是吸水性。[实验2现象]:可以看到白糖变黑,体积膨胀,形成“黑面包”。[引导]蔗糖的分子式为C12H22O11,黑色产物是碳,这里究竟发生什么变化?[讨论]蔗糖中含有C、H、O三种元素,与浓硫酸作用后生成了碳,说明蔗糖分子里的氢和氧失去了。[总结]这个反应中浓硫酸是“横刀夺爱”,因蔗糖中失去的氢、氧原子个数之比为2:1,正好符合水的组成(H2O)。[整合]吸水性中的“水”以水分子形式存在,而脱水性中的“水”没有水分子,反应生成了水分子的。[分组讨论探索]:黑面包体积为什么会变大?气体是怎么产生的?用心爱心专心[过渡]浓硫酸使蔗糖脱水后,又吸水放热,使生成的碳继续被浓硫酸氧化。1:浓硫酸的吸水性和脱水性[板书](1)吸水性——利用此性质,可用浓硫酸来干燥不与其反应的气体。[过渡]若物质中没有现存的水分子,但有H、O两种元素,遇到浓H2SO4情况怎样呢?[演示]在一张纸上用浓硫酸写‘化学’字。[实验现象]:浓硫酸接触到的地方马上变黑,这说明浓硫酸是什性质?[板书](2)脱水性[分析]:浓硫酸可将许多有机物脱水,反应时,按水分子里氢、氧原子个数比(2:1)夺取这些有机物里的氢原子和氧原子,使其炭化。[学生实验探索]:请同学们根据实验的现象分析浓硫酸在反应中起的是什么作用?2:浓硫酸的强氧化性[实验三]:在试管中加放入铜片,再加3ml浓硫酸,用装有玻璃导的单孔胶塞塞好,加热,放出的气体通入品红溶液中。观察品红的颜色变化和试管中水溶液的颜色。[探索]根据实验现象判断反应产物,写出反应的化学方程式:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O[讨论]分析元素化合价升降情况,指出哪种物质是氧化剂,哪种物质是还原剂。[思考]用Cu、浓H2SO4、水、空气为原料,如何制取CuSO4,考虑经济效益和社会效益。[启发]Cu是H之后的较不活泼金属,那么H之前的金属是否就更容易被浓H2SO4氧化呢...