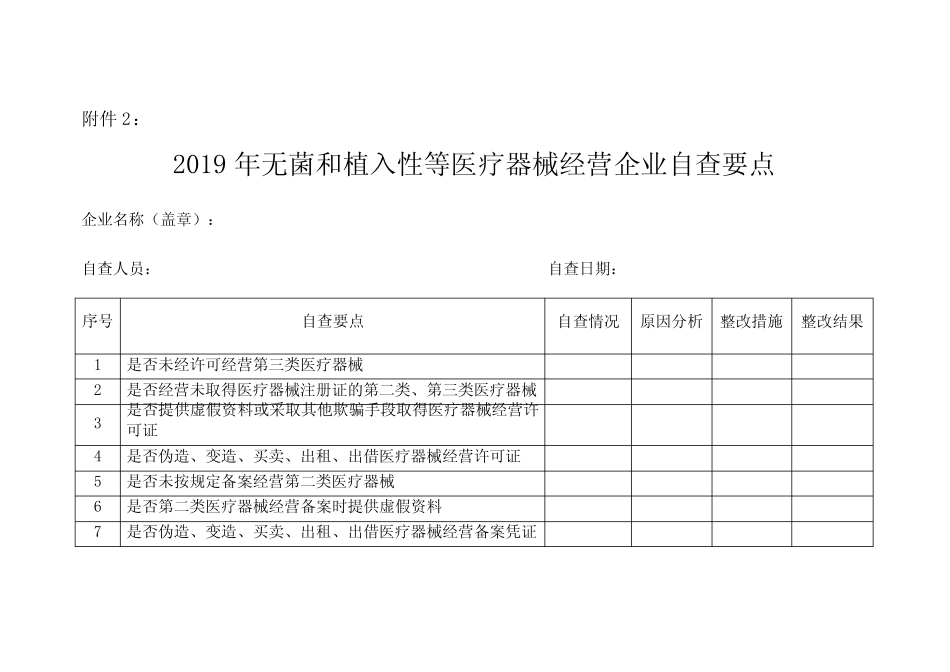
医疗器械重点监管产品目录1.一次性使用无菌医疗器械(输注器具、塑料血袋、采血器等)2.植入(介入)性等高风险医疗器械(心脏起搏器、心脏瓣膜、心血管支架、导管导丝导鞘、骨科内固定器械、栓塞器械、人工血管、宫内节育器等)、医用可吸收缝合线;3.体外诊断试剂(用于微生物鉴别或药敏试验的微生物培养基,血液配型、艾滋病、梅毒、甲肝、乙肝、丙肝、结核、甲胎蛋白、癌胚抗原等检测试剂);4.医用分子筛制氧设备、婴儿培养箱、血液透析设备、呼吸机、输注泵;5.超声诊断仪、X射线设备。6.注射用透明质酸钠、角膜接触镜(含装饰性平光隐形眼镜、角膜塑形镜)、避孕套;7.体验式销售的物理康复治疗设备、高电位治疗仪、电场治疗仪、光波康复理疗仪;附件2:2019年无菌和植入性等医疗器械经营企业自查要点企业名称(盖章):自查人员:自查日期:序号自查要点自查情况原因分析整改措施整改结果1是否未经许可经营第三类医疗器械2是否经营未取得医疗器械注册证的第二类、第三类医疗器械3是否提供虚假资料或采取其他欺骗手段取得医疗器械经营许可证4是否伪造、变造、买卖、出租、出借医疗器械经营许可证5是否未按规定备案经营第二类医疗器械6是否第二类医疗器械经营备案时提供虚假资料7是否伪造、变造、买卖、出租、出借医疗器械经营备案凭证8是否擅自变更经营场所或者库房地址、扩大经营范围或者擅自设立库房9是否未按规定办理登记事项变更10是否经营不符合强制性标准或不符合经注册或备案的产品技术要求的医疗器械11是否经营无合格证明文件、过期、失效、淘汰的医疗器械12是否经营说明书、标签不符合规定的医疗器械13是否未按照医疗器械说明书和标签标示要求运输、贮存医疗器械14是否未依照规定建立并执行医疗器械进货查验记录制度15是否从事第二类、第三类医疗器械批发业务以及第三类医疗器械零售业务的经营企业未依照规定建立并执行销售记录制度16是否派出销售人员销售医疗器械,未按要求提供授权书17经营条件发生变化,不再符合医疗器械经营质量管理规范要求,是否未按照规定进行整改18是否从不具有资质的生产、经营企业购进医疗器械19监管部门责令实施召回或停止经营后,是否拒不停止经营(召回)医疗器械20是否未开展医疗器械不良事件监测21企业质量负责人是否负责医疗器械质量管理工作,独立履行职责,在企业内部对医疗器械质量管理具有裁决权,承担相应的质量管理责任。22企业质量管理机构或者质量管理人员是否全面履行职责。23企业是否依据《医疗器械经营质量管理规范》建立覆盖医疗器械经营全过程的质量管理制度,并保存相关记录或者档案。24从事第二类、第三类医疗器械批发业务和第三类医疗器械零售业务的企业开展购货者资格审核、医疗器械追踪溯源情况。25第三类医疗器械经营企业是否建立质量管理自查制度,是否于每年年底前向所在地设区的负责医疗器械监督管理的部门提交年度自查报告。26进货查验记录和销售记录是否保存至医疗器械有效期后2年;无有效期的,不得少于5年。植入类医疗器械进货查验记录和销售记录是否永久保存。27企业法定代表人(负责人)、质量管理人员是否有相关法律法规禁止从业的情形。28企业是否具有与经营范围和经营规模相适应、独立的经营场所和库房,经营场所和库房的面积是否满足经营要求。29库房的选址、设计、布局、建造、改造和维护是否符合医疗器械贮存的要求,能防止医疗器械的混淆、差错或被污损,并具有符合医疗器械产品特性要求的贮存设施、设备。30对有特殊温湿度贮存要求的医疗器械,是否配备有效调控及监测温湿度的设备或者仪器。31经营第三类医疗器械的企业,是否具有符合医疗器械经营质量管理要求的计算机信息管理系统,保证经营的产品可追溯。32企业为其他医疗器械生产经营企业提供贮存、配送服务,是否符合以下要求:(一)具备从事现代物流储运业务的条件;(二)具有与委托方实施实时电子数据交换和实现产品经营全过程可追溯、可追踪管理的计算机信息平台和技术手段;(三)具有接受食品药品监督管理部门电子监管的数据接口;(四)食品药品监督管理部门的其他有关要求。33企业在采购前是否审核供货者的合法资格、所购入医疗...