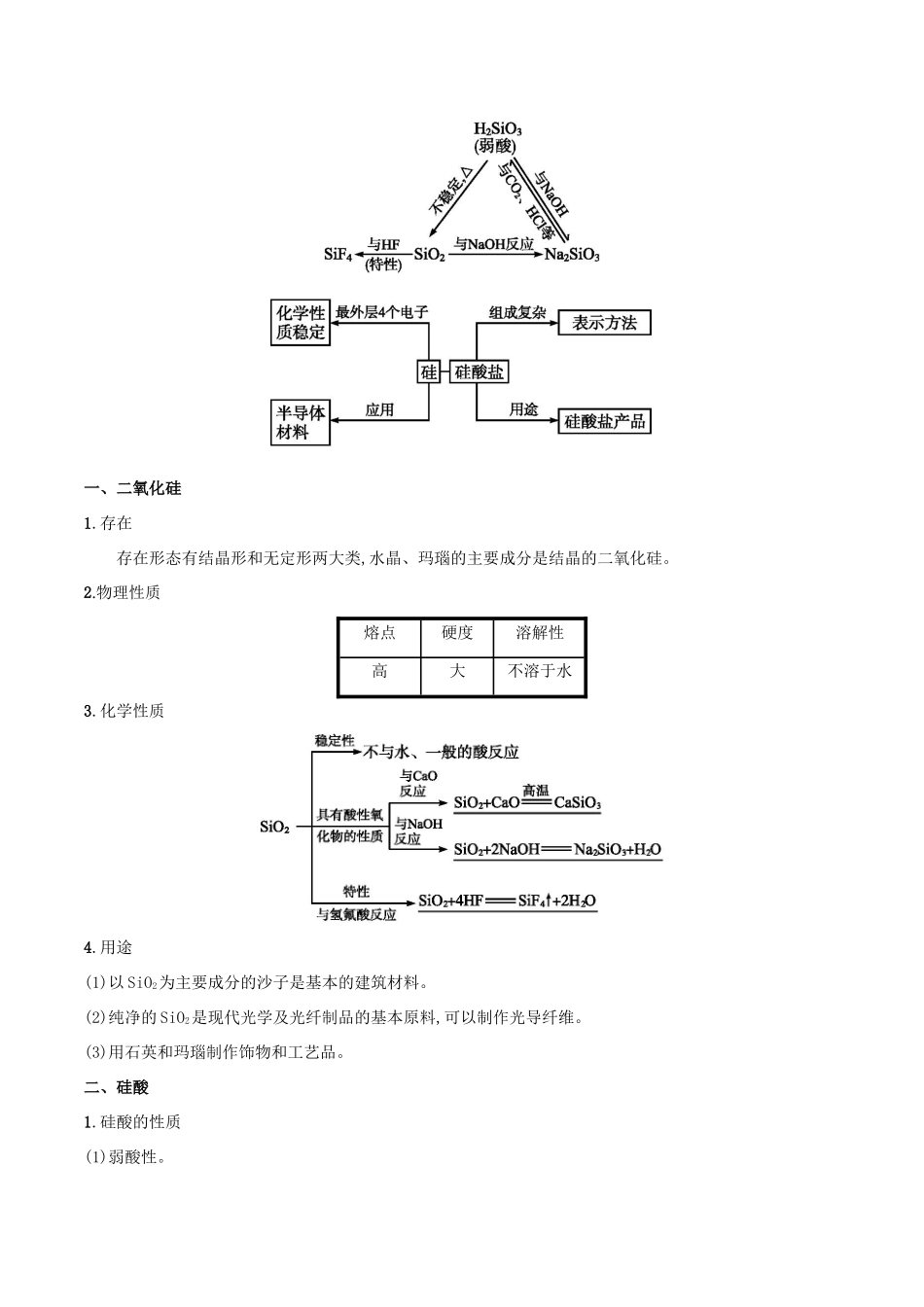
专题19无机非金属材料的主角——硅【知识回放】1.碳和硅在自然界中以什么形式存在?2.CO2的物理性质:是一种色体,溶于水,固态CO2俗称。3.完成以下方程式:(1)CO2+H2O→(2)CO2+NaOH→(3)CO2+CaO→4.请写出硅原子和碳原子的原子结构示意图。5.根据Na2CO3+SiO2Na2SiO3+CO2↑能说明硅酸酸性比碳酸强吗?6.由于SiO2既可与碱反应,也可与氢氟酸反应,所以SiO2为两性氧化物,这种说法是否正确?【答案】1.碳在自然界中有游离态和化合态两种形式存在,硅在自然界中以化合态存在。2.无色无味气体能干冰3.(1)CO2+H2O=H2CO3(2)CO2+2NaOH=Na2CO3+H2O(3)CO2+CaO=CaCO34.【新知精讲】一、二氧化硅1.存在存在形态有结晶形和无定形两大类,水晶、玛瑙的主要成分是结晶的二氧化硅。2.物理性质熔点硬度溶解性高大不溶于水3.化学性质4.用途(1)以SiO2为主要成分的沙子是基本的建筑材料。(2)纯净的SiO2是现代光学及光纤制品的基本原料,可以制作光导纤维。(3)用石英和玛瑙制作饰物和工艺品。二、硅酸1.硅酸的性质(1)弱酸性。向Na2SiO3溶液中通入CO2,反应的化学方程式为Na2SiO3+CO2+H2O===H2SiO3(胶体)+Na2CO3或Na2SiO3+2CO2+2H2O===H2SiO3(胶体)+2NaHCO3。结论:H2SiO3酸性比H2CO3酸性弱。(2)不稳定性。H2SiO3受热易分解,化学方程式为H2SiO3SiO2+H2O。2.硅酸的制备(1)Na2SiO3溶液与CO2的反应:Na2SiO3+CO2+H2O===H2SiO3(胶体)+Na2CO3。(2)Na2SiO3与盐酸的反应:Na2SiO3+2HCl===H2SiO3(胶体)+2NaCl。3.硅酸的存在及用途(1)浓度小时:形成硅酸溶胶。(2)浓度大时:形成硅酸凝胶。(3)硅胶。硅酸凝胶经干燥脱水得到的硅酸干凝胶,称为“硅胶”,具有很强的吸水性,常用作干燥剂或催化剂的载体。三、硅酸盐1.概念硅酸盐是由硅、氧和金属元素组成的化合物的总称。2.硅酸盐的性质硅酸盐是一大类结构复杂的固态物质,大多不溶于水,化学性质很稳定。3.硅酸盐组成的表示通常用二氧化硅和金属氧化物的组合形式表示其组成。例如:Na2SiO3:Na2O·SiO2;长石KAlSi3O8:K2O·Al2O3·6SiO2。4.最常见的硅酸盐——Na2SiO3Na2SiO3的水溶液俗称水玻璃,能制备硅胶和木材防火剂。5.三种常见的硅酸盐产品硅酸盐产品原料主要设备水泥石灰石、黏土水泥回转窑玻璃纯碱、石灰石和石英玻璃窑陶瓷黏土—6.其他含硅的物质物质性质用途SiC俗称金刚砂,具有金刚石结构,硬度很大砂纸、砂轮的磨料含4%硅的硅钢很高的导磁性变压器铁芯硅橡胶既耐高温又耐低温,在-60~250℃保持良好的弹性制造火箭、导弹、飞机的零件和绝缘材料等人工制造的分子筛(铝硅酸盐)有均匀微孔结构作吸附剂和催化剂四、硅单质1.种类:单质硅有晶体和无定形两类。2.结构:晶体硅的结构与金刚石相似。3.性质(1)物理性质:色、态光泽熔点硬度质地导电性灰黑色固体金属光泽高大脆半导体(2)化学性质:在常温下化学性质不活泼,但能与氢氟酸、强碱发生反应。4.用途(1)半导体材料,如硅芯片等。(2)新型能源,如光电池等。【科学探究】探究一二氧化硅的性质问题导引二氧化硅的平面结构1.实验室保存NaOH溶液时为何不能使用玻璃塞?提示因NaOH会与玻璃的主要成分SiO2反应,生成的Na2SiO3溶液会使瓶塞与瓶口黏连在一起。2.SiO2既能与NaOH溶液反应,也能与氢氟酸反应,SiO2属于两性氧化物吗?探究二硅酸的性质和制备问题导引硅酸的制备实验操作实验现象滴加酚酞溶液后溶液呈红色,滴加稀盐酸后溶液变为无色,有白色胶状沉淀生成1.SiO2属于酸性氧化物,能否用SiO2与H2O直接反应制取H2SiO3?提示不能。虽然SiO2属于酸性氧化物,但SiO2难溶于水,无法用SiO2与H2O反应制取H2SiO3,可用Na2SiO3与酸反应制取。2.已知SiO2+Na2CO3Na2SiO3+CO2↑,这能否证明硅酸的酸性比碳酸强?提示不能。该反应是在高温下进行,产物中CO2为气体,生成后脱离反应体系,使反应能向右进行到底。探究三硅酸盐的组成和性质问题导引常见的硅酸盐矿物1.思考:硅酸盐可写成二氧化硅和金属氧化物的形式,是否可理解成硅酸盐是二氧化硅和金属氧化物的混合物?提示不可以。硅酸盐结构复杂,只是用二氧化硅和金属氧化物的形式来表示,并不是它们的混合物。2.请结合硅酸盐的性质,分析在实验室里如何保存Na2SiO3溶液?如果敞口放置一段时间,...