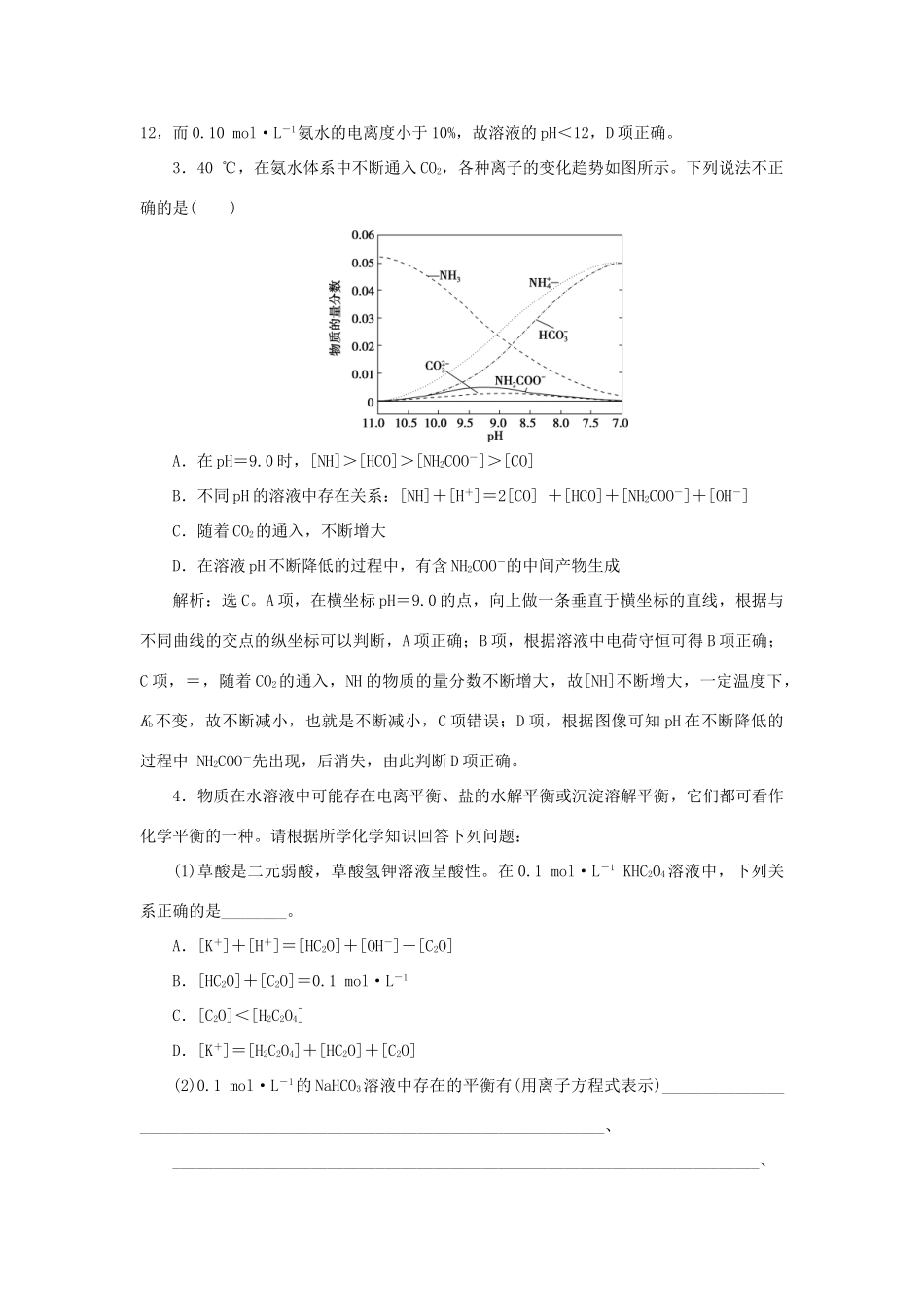
突破全国卷专题讲座(九)水溶液中离子平衡的综合应用[备考分析]考查方式主要有①弱电解质的电离平衡与影响因素及电离常数的应用;②水的电离平衡与影响因素及KW的应用;③溶液的酸碱性及pH的计算、pH大小的比较;④盐类水解的知识与应用(包括盐类水解规律、影响因素、盐溶液酸碱性的判断、盐类水解反应离子方程式的书写等);⑤电解质溶液中粒子浓度的大小关系;⑥难溶电解质的溶解平衡及Ksp的应用等。[解题策略]电解质溶液既是中学化学理论知识的重点,又是高考考查的热点。电解质溶液知识主要包括弱电解质的电离、溶液的酸碱性、盐类的水解和难溶电解质的溶解平衡等。电解质溶液知识除在选择题中单独命题外,在非选择题中也常单独命题。(1)将化学平衡理论迁移和应用到水的电离平衡、弱电解质的电离平衡、盐类的水解平衡、沉淀溶解平衡中,利用勒·夏特列原理解决平衡的移动问题。(2)利用KW、Ka、Kb、Ksp的表达式进行变换,计算溶液中离子的浓度,进行pH计算等。(3)比较溶液中粒子浓度大小时,仔细审题分析电离和水解的应用,结合三个守恒关系(电荷守恒、物料守恒、质子守恒)解决问题。①同一溶液中离子浓度大小的比较b.②不同溶液中同一离子浓度大小的比较要注意溶液中离子间的相互影响,如CH3COONH4溶液中CH3COO-和NH的水解相互促进;NH4HSO4溶液中NH4HSO4电离出的H+抑制NH的水解。故等物质的量浓度的CH3COONH4、NH4HSO4和NH4Cl溶液中[NH]的大小关系:NH4HSO4>NH4Cl>CH3COONH4。[突破训练]1.(2016·高考全国卷Ⅲ,13,6分)下列有关电解质溶液的说法正确的是()A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中减小B.将CH3COONa溶液从20℃升温至30℃,溶液中增大C.向盐酸中加入氨水至中性,溶液中>1D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变解析:选D。CH3COOH溶液中存在电离平衡:CH3COOHCH3COO-+H+,加水平衡正向移动,n(H+)增大,n(CH3COOH)减小,所以增大,A项错误。CH3COONa溶液中存在水解平衡:CH3COO-+H2OCH3COOH+OH-,水解反应属于吸热反应,升高温度,水解平衡常数增大,即增大,则减小,B项错误。根据电荷守恒:[NH]+[H+]=[Cl-]+[OH-],溶液呈中性,则[H+]=[OH-],[NH]=[Cl-],所以[NH]与[Cl-]的比值为1,C项错误。向AgCl、AgBr的饱和溶液中加入AgNO3后Ag+浓度不变,由于Ksp不变,故[Cl-]与[Br-]的比值也不变,D项正确。2.(2016·高考全国卷Ⅰ,12,6分)298K时,在20.0mL0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是()A.该滴定过程应选择酚酞作为指示剂B.M点对应的盐酸体积为20.0mLC.M点处的溶液中[NH]=[Cl-]=[H+]=[OH-]D.N点处的溶液中pH<12解析:选D。当恰好完全中和时,生成NH4Cl,而NH4Cl溶液呈酸性,酚酞的变色范围为pH=8.2~10.0,甲基橙的变色范围为pH=3.1~4.4,故应选甲基橙作指示剂,A项错误;当V(盐酸)=20.0mL时,恰好完全反应,溶液呈酸性,B项错误;M点时由溶液中电荷守恒知[NH]+[H+]=[Cl-]+[OH-],298K时,pH为7的溶液呈中性,即[H+]=[OH-],则[NH]=[Cl-],但[NH]=[Cl-]≫[H+]=[OH-],C项错误;该温度下,0.10mol·L-1一元强碱溶液的pH=13,若0.10mol·L-1一元弱碱溶液的电离度为10%,则其pH=12,而0.10mol·L-1氨水的电离度小于10%,故溶液的pH<12,D项正确。3.40℃,在氨水体系中不断通入CO2,各种离子的变化趋势如图所示。下列说法不正确的是()A.在pH=9.0时,[NH]>[HCO]>[NH2COO-]>[CO]B.不同pH的溶液中存在关系:[NH]+[H+]=2[CO]+[HCO]+[NH2COO-]+[OH-]C.随着CO2的通入,不断增大D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成解析:选C。A项,在横坐标pH=9.0的点,向上做一条垂直于横坐标的直线,根据与不同曲线的交点的纵坐标可以判断,A项正确;B项,根据溶液中电荷守恒可得B项正确;C项,=,随着CO2的通入,NH的物质的量分数不断增大,故[NH]不断增大,一定温度下,Kb不变,故不断减小,也就是不断减小,C项错误;D项,根据...