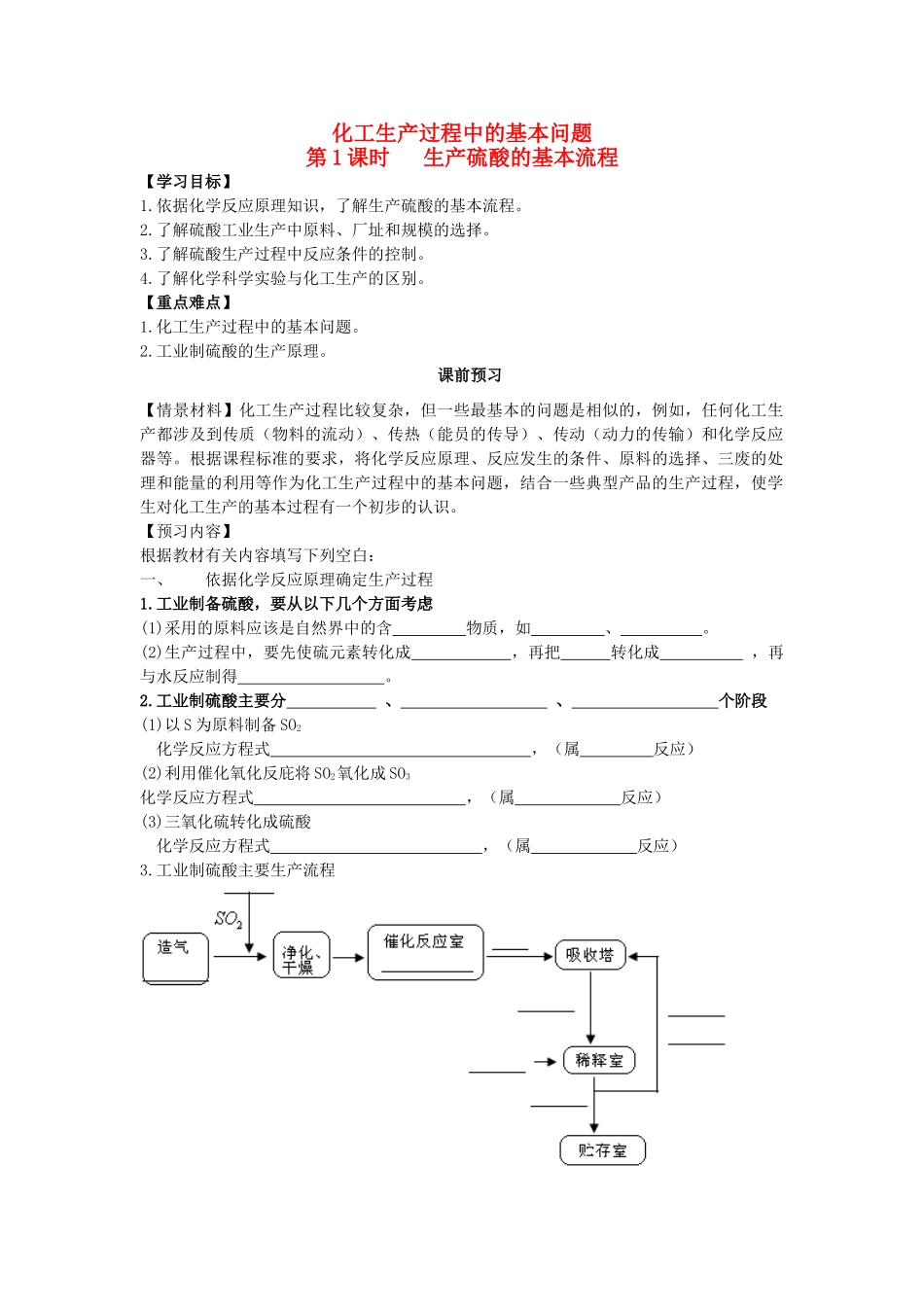
化工生产过程中的基本问题第1课时生产硫酸的基本流程【学习目标】1.依据化学反应原理知识,了解生产硫酸的基本流程。2.了解硫酸工业生产中原料、厂址和规模的选择。3.了解硫酸生产过程中反应条件的控制。4.了解化学科学实验与化工生产的区别。【重点难点】1.化工生产过程中的基本问题。2.工业制硫酸的生产原理。课前预习【情景材料】化工生产过程比较复杂,但一些最基本的问题是相似的,例如,任何化工生产都涉及到传质(物料的流动)、传热(能员的传导)、传动(动力的传输)和化学反应器等。根据课程标准的要求,将化学反应原理、反应发生的条件、原料的选择、三废的处理和能量的利用等作为化工生产过程中的基本问题,结合一些典型产品的生产过程,使学生对化工生产的基本过程有一个初步的认识。【预习内容】根据教材有关内容填写下列空白:一、依据化学反应原理确定生产过程1.工业制备硫酸,要从以下几个方面考虑(1)采用的原料应该是自然界中的含物质,如、。(2)生产过程中,要先使硫元素转化成,再把转化成,再与水反应制得。2.工业制硫酸主要分、、个阶段(1)以S为原料制备SO2化学反应方程式,(属反应)(2)利用催化氧化反庇将SO2氧化成SO3化学反应方程式,(属反应)(3)三氧化硫转化成硫酸化学反应方程式,(属反应)3.工业制硫酸主要生产流程二、生产中原料的选择工业生产某种化工产品,选择原料时,要从多方面虑,如、、原料、能源、工业用水的供应能力、储存、运输、预处理成本及环境保护等。(1)从基建投资、加工费用及环保方面考虑,用制硫酸优于用制硫酸。(2)我国天然硫资源,而且开采条件。(3)我国黄铁矿储量比天然硫要。(4)硫黄制硫酸比黄铁矿制硫酸生产流程、设备、三废少,劳动生产率,易于设备。(5)由于原料多需进口,硫黄制硫酸成本比黄铁矿制硫酸。三、生产中反应条件的控制1.硫酸工业生产的三个主要设备是、、。2.温度较时,越有利于SO2转化为SO3,通常选择作为操作的温度,因为在这个温度范围内,和都比较理想。3.压强的增大,SO2的转化率。通常采用操作。4.催化剂:催化剂对化学平衡,但能改变到达平衡所需的时间,即增大。预习内容答案一、1.(1)硫硫黄黄铁矿(主要成分FeS2)(2)SO2SO2SO3H2SO42.造气催化氧化吸收(1)S(s)+O2(g)=SO2(g)放热(2)2SO2(g)+O2(g)2SO3(g)放热(3)SO3(g)+H2O(l)=H2SO4(1)放热3.空气制SO2400~500℃常压、催化剂SO3发烟硫酸水98%硫酸98%硫酸二、化学反应原理厂址选择(1)硫黄黄铁矿(2)缺乏比较复杂(3)大(4)短简单治理量高大型化(5)高三、1.沸腾炉接触室吸收塔2.低400~500℃反应速率二氧化硫的转化率3.变化不大常压4.没有影响化学反应速率课堂互动【问题探究1】对于某一具体的化工产品,研究生产过程要从产品的化学组成和性质考虑,来确定原料和生产路线。请结合课本写出关于工业制硫酸的反应原理和过程?【教师点拨】掌握七个“三”,即“三阶段”、“三原料”、“三反应”、“三设备”、“三杂质”、“三净化”、“三原理”。分析解答:化工生产是以化学反应原理为依据,以实验室研究为基础的。任何生产的完成都要符合化学反应规律。【即学即练1】在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是()A.硫铁矿燃烧前要粉碎,因为大块的硫铁矿不能燃烧B.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便SO3吸收完全C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率D.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应1.B【解析】本题考查化工生产中的技术处理问题。可从化学反应速率、化学平衡移动及实际生产三个方面考虑各种操作条件的原因。矿石粉碎是为了提高反应速率,并不是因为大块的硫铁矿不能燃烧;用浓硫酸吸收SO3是为了防止水与其形成酸雾;使用催化剂可以提高反应速率,但不能提高SO2的转化率;从沸腾炉出来的炉气需净化,因为炉气中杂质会使催化剂中毒。【问题探究2】阅读P6表1-1,结合二氧化硫催化氧化的反应特点:是否温度越低越有利于SO2转化为SO3?阅读P6表1-2,分析随压强的增大,SO2的转化率怎么改变?是否压强越高越好?【教师点拨】反应方程式2SO2(g)+O2(g)2SO3(g),属放热...