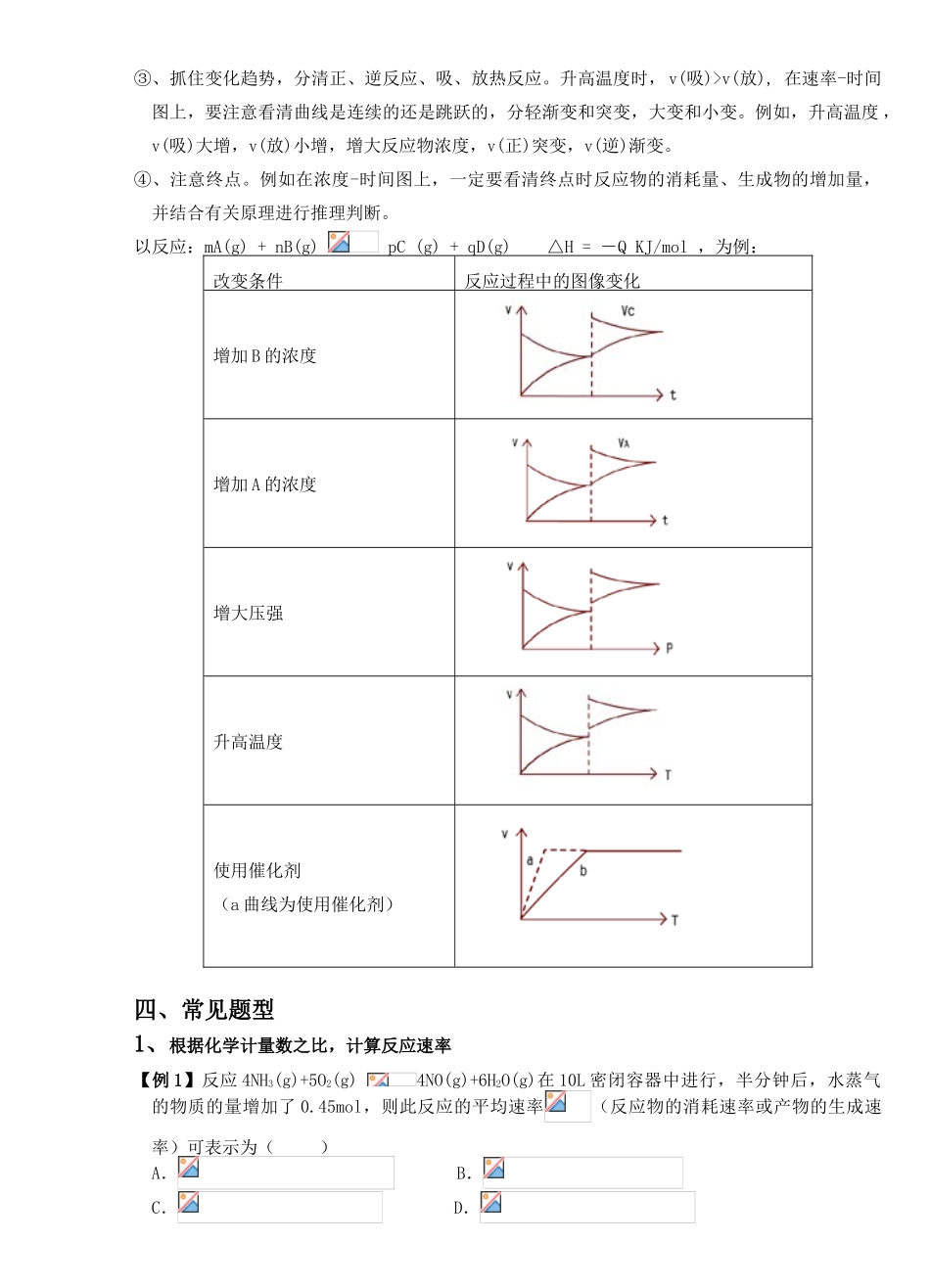
28 化学反应速率一、化学反应速率1、定性概念:所谓化学反应速率即表示一个化学反应进行的快与慢(适用所有的化学反应)最初就是用快(象 H2、O2爆炸)慢(铁生锈),这快、慢是定性描述。2、定量概念:通常用单位时间里反应物浓度的减少或生成物浓度的增加来表示。3、表示方法:v = △c/△t注意:① v 是平均速率还是瞬时速率?(平均,因为开始时浓度大、速率大)② 同一反应在不同时刻,瞬时反应速率不同.③ 同一反应在不同时间内,平均反应速率不同.④ 同一反应用不同物质表示反应速率数值是否一定相同?(不一定,但表示的意义完全相同)。同一反应中,各物质的速率之比一定等于其计量系数之比。⑤ 当反应物是固体时能否定量表示反应速率?(能,虽然固体不能讲浓度,但用单位时间物质的量减小或增大来表示)而且固体物质的颗粒大小影响反应速率。⑥ 中学阶段计算的是平均反应速率,图示的应是瞬时速率.4、单位:mol/(L·s) ;mol/(L·min);mmol/L·s.5、相互关系:如:4NH3 + 5O2 4NO + 6H2O(g)v(NH3) :v(O2) :v(NO) :v(H2O) == 4:5:4:66、原因解释① 活化分子:能够发生有效碰撞的分子叫活化分子,必须指出,只有活化分子之间的碰撞才可能发生有效碰撞,但活化分子之间的每一次碰撞并不一定发生化学反应——还需合适的取向。② 有效碰撞:气体分子间的每次碰撞并不都发生化学反应,即为无效碰撞,只有能够发生化学反应的碰撞才叫有效碰撞。③ 活化分子百分数:某一反应中的活化分子数占反应物总数的百分率,对于一定条件下的某一反应来说,其活化分子百分数是一定的。二、影响化学反应速率的因素一)、内因(决定性,化学上不可改变的。):反应物本身的性质,成为活化分子所需能量低,甚至常温下就是活分分子。(如:氢气与氧气反应肯定比煤的形成要快)。但同一反应,不同条件,反应速率不相同。二)、外因:1、浓度:浓度越大,分子之间距离越短,即增加单位体积内活化分子的数量,但活化分子的百分率并不发生变化。分子之间碰撞机会增大,发生化学反应的几率加大,化学反应速率就快;因此,化学反应速率与浓度有密切的关系,浓度越大,化学反应速率越快。增大反应物的浓度 ,正反应速率加快。例如:硫在纯氧中燃烧比在空气中燃烧更剧烈等。注意:浓度一般指气体或溶液,纯液体或固体浓度是一定值,量的增减一般不影响反应速率。对可逆反应,浓度改变可以是反应物或生成物或同时改变,但均符合“浓快稀慢”...