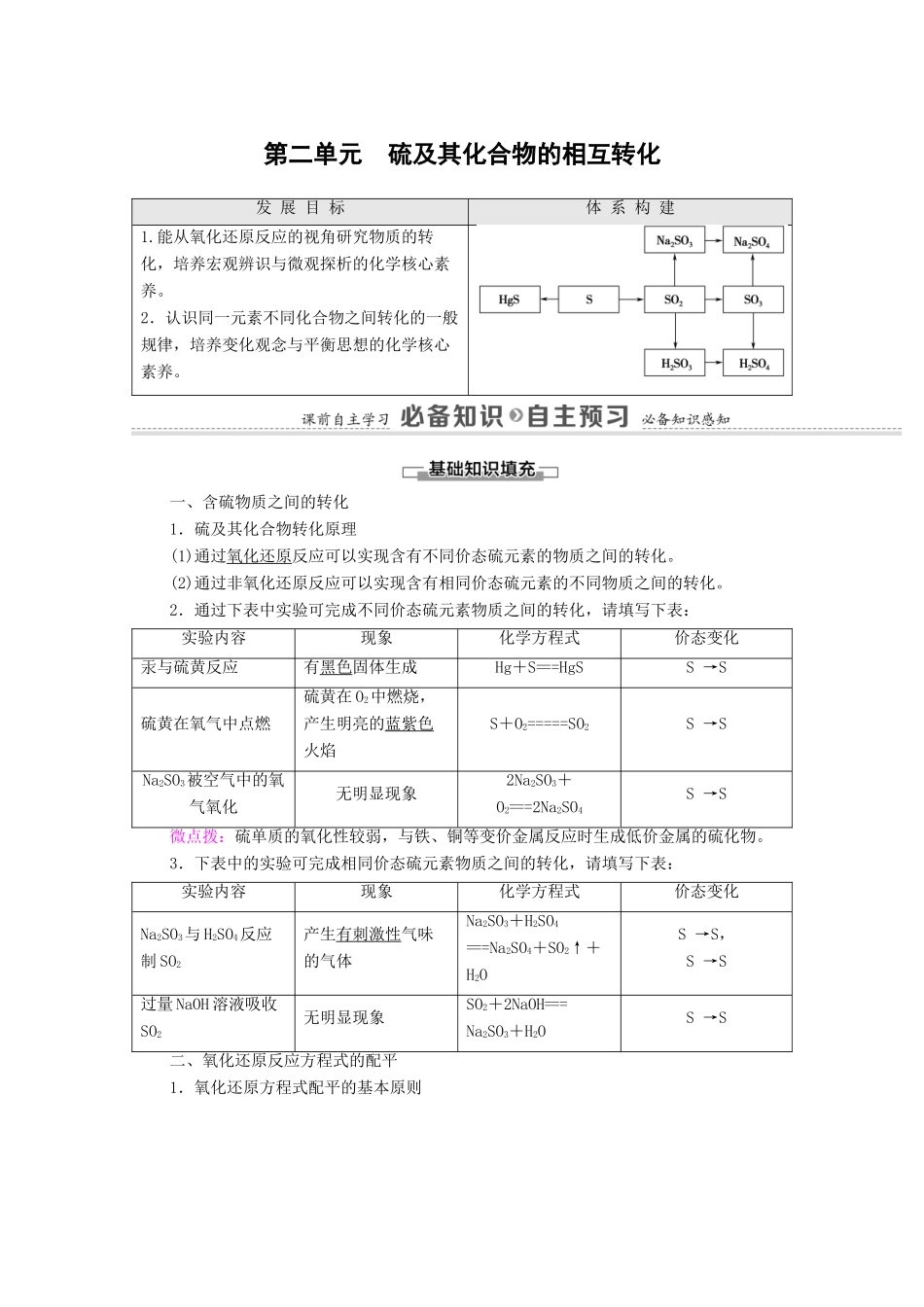
第二单元 硫及其化合物的相互转化发 展 目 标体 系 构 建1.能从氧化还原反应的视角研究物质的转化,培养宏观辨识与微观探析的化学核心素养。2.认识同一元素不同化合物之间转化的一般规律,培养变化观念与平衡思想的化学核心素养。一、含硫物质之间的转化1.硫及其化合物转化原理(1)通过氧化还原反应可以实现含有不同价态硫元素的物质之间的转化。(2)通过非氧化还原反应可以实现含有相同价态硫元素的不同物质之间的转化。2.通过下表中实验可完成不同价态硫元素物质之间的转化,请填写下表:实验内容现象化学方程式价态变化汞与硫黄反应有黑色固体生成Hg+S===HgSS →S 硫黄在氧气中点燃硫黄在 O2中燃烧,产生明亮的蓝紫色火焰S+O2=====SO2S →S Na2SO3被空气中的氧气氧化无明显现象2Na2SO3+O2===2Na2SO4S →S 微点拨:硫单质的氧化性较弱,与铁、铜等变价金属反应时生成低价金属的硫化物。3.下表中的实验可完成相同价态硫元素物质之间的转化,请填写下表:实验内容现象化学方程式价态变化Na2SO3与 H2SO4反应制 SO2产生有刺激性气味的气体Na2SO3+H2SO4===Na2SO4+SO2↑+H2OS →S,S →S 过量 NaOH 溶液吸收SO2无明显现象SO2+2NaOH===Na2SO3+H2OS →S 二、氧化还原反应方程式的配平1.氧化还原方程式配平的基本原则2.氧化还原反应方程式配平的步骤(1)标变价:写出反应物、生成物的化学式。在化学方程式中标出化合价发生变化的元素的化合价。C+H2SO4(浓)——CO2+SO2+H2O(2)列得失:根据化合价的变化标出电子转移的方向和数目。(4)配系数:根据质量守恒定律配平其他物质的化学计量数,并添加气体符号,注明反应条件,将单线改为双线。C+2H2SO4(浓)=====CO2↑+2SO2↑+2H2O1.判断正误(正确的打“√”,错误的打“×”。)(1)含硫化合物间的转化,既可以通过氧化还原反应实现,也可以通过非氧化还原反应实现。(√)(2)向 H2S 溶液中通入空气,溶液变浑浊,是因为发生了氧化还原反应。(√)(3)浓硫酸具有强氧化性,SO2具有还原性,所以浓硫酸不能干燥 SO2。(×)(4)因为 Cu(或 Fe)与 Cl2反应生成高价态的氯化物,而 Cu(或 Fe)与 S 反应生成低价态的硫化物,所以氧化性:Cl2>S。(√)2.配平下列化学方程式(1)NH3+O2===NO+H2O(2)MnO+Cl-+H+===Mn2++Cl2↑+H2O[答案] (1)4 5 4 6 (2)2 10 16 2 5 83.Na2SO3 中有+4 价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S 溶液、Na2SO3溶...