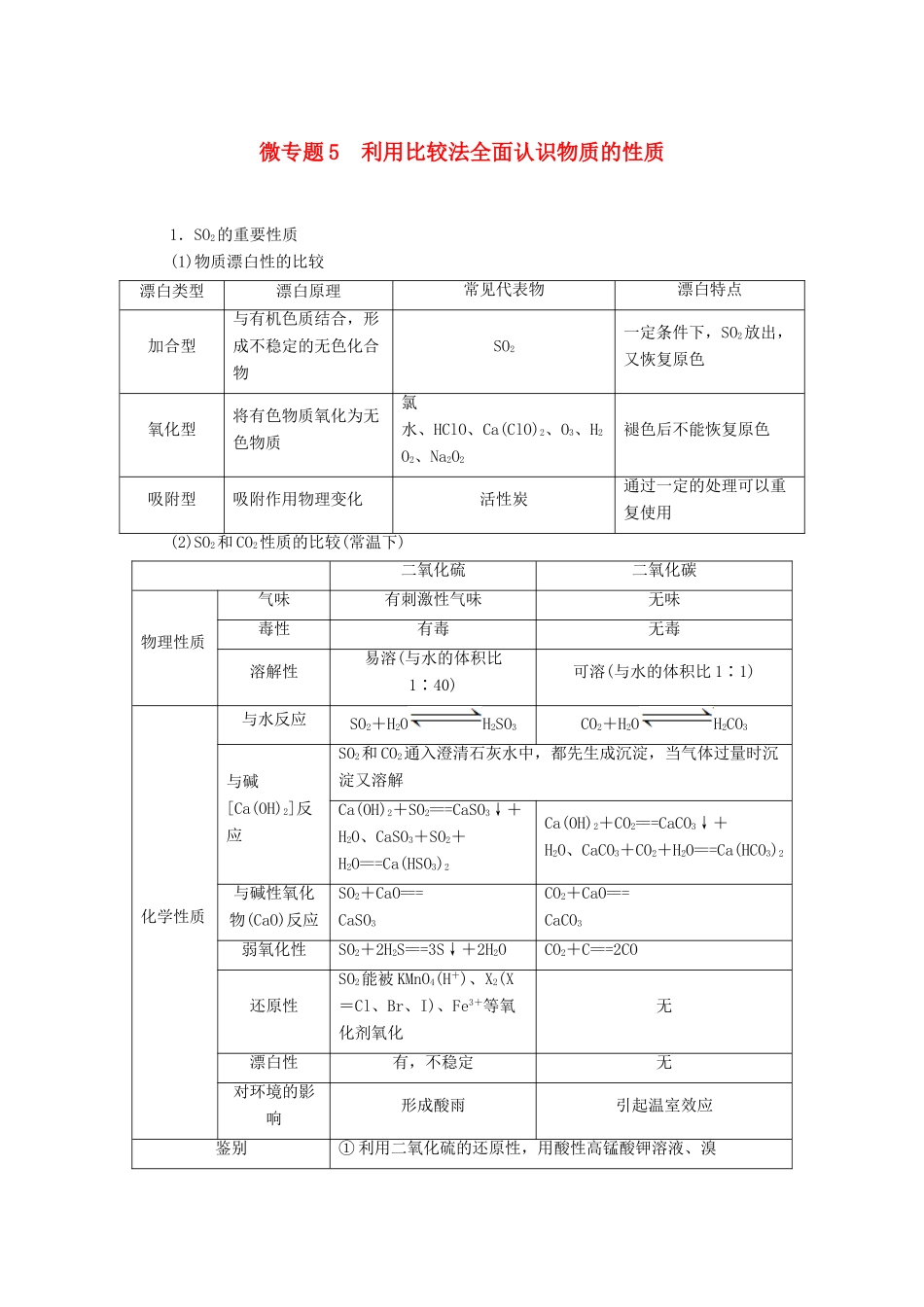
微专题 5 利用比较法全面认识物质的性质1.SO2的重要性质(1)物质漂白性的比较漂白类型漂白原理常见代表物漂白特点加合型与有机色质结合,形成不稳定的无色化合物SO2一定条件下,SO2放出,又恢复原色氧化型将有色物质氧化为无色物质氯水、HClO、Ca(ClO)2、O3、H2O2、Na2O2褪色后不能恢复原色吸附型吸附作用物理变化活性炭通过一定的处理可以重复使用(2)SO2和 CO2性质的比较(常温下)二氧化硫二氧化碳物理性质气味有刺激性气味无味毒性有毒无毒溶解性易溶(与水的体积比1∶40)可溶(与水的体积比 1∶1)化学性质与水反应SO2+H2OH2SO3CO2+H2OH2CO3与碱[Ca(OH)2]反应SO2和 CO2通入澄清石灰水中,都先生成沉淀,当气体过量时沉淀又溶解Ca(OH)2+SO2===CaSO3↓+H2O、CaSO3+SO2+H2O===Ca(HSO3)2Ca(OH)2+CO2===CaCO3↓+H2O、CaCO3+CO2+H2O===Ca(HCO3)2与碱性氧化物(CaO)反应SO2+CaO===CaSO3CO2+CaO===CaCO3弱氧化性SO2+2H2S===3S↓+2H2OCO2+C===2CO还原性SO2能被 KMnO4(H+)、X2(X=Cl、Br、I)、Fe3+等氧化剂氧化无漂白性有,不稳定无对环境的影响形成酸雨引起温室效应鉴别① 利用二氧化硫的还原性,用酸性高锰酸钾溶液、溴水、FeCl3溶液、H2O2等鉴别② 利用二氧化硫的漂白性,用品红溶液鉴别2.浓、稀硫酸的判断方法(1)称量:取等体积,重者为浓硫酸(用手掂掂也能分辨出来)。(2)放出 H2:分别加入到有铁片的试管中,放出气体者为稀硫酸。(3)脱水性:用玻璃棒分别蘸取试样在纸上写字,在常温下,一会儿变黑者为浓硫酸。也可用锯末、蔗糖等做相似的实验。(4)吸水性:加到 CuSO4·5H2O 晶体中,使晶体变白者为浓硫酸,得蓝色溶液者为稀硫酸。(5)吸水性:各取等质量试样,敞口放置一段时间后称量,增重者为浓硫酸。(6)氧化性:分别加入到有铜片的试管中,加热,放出刺激性气味气体者为浓硫酸。(7)酸碱指示剂:在蓝色石蕊试纸上滴 1~2 滴待测溶液,变红色者为稀硫酸,先变红再变黑者为浓硫酸。1.酸雨的形成是一种复杂的大气化学和光学化学过程,在清洁空气、污染空气中形成硫酸型酸雨的过程如图:下列有关说法错误的是( )A.光照能引发酸雨的形成B.所涉及的变化均为氧化还原反应C.污染空气能加快酸雨的形成D.优化能源结构能有效遏制酸雨污染B [由图示可知,酸雨形成的两个途径中都使用了光照的条件, A 正确;三氧化硫与水反应生成硫酸,没有化合价变化,不属于氧化还原反应, B 错误;由图中信息可知,污染空气中的氮的氧化...