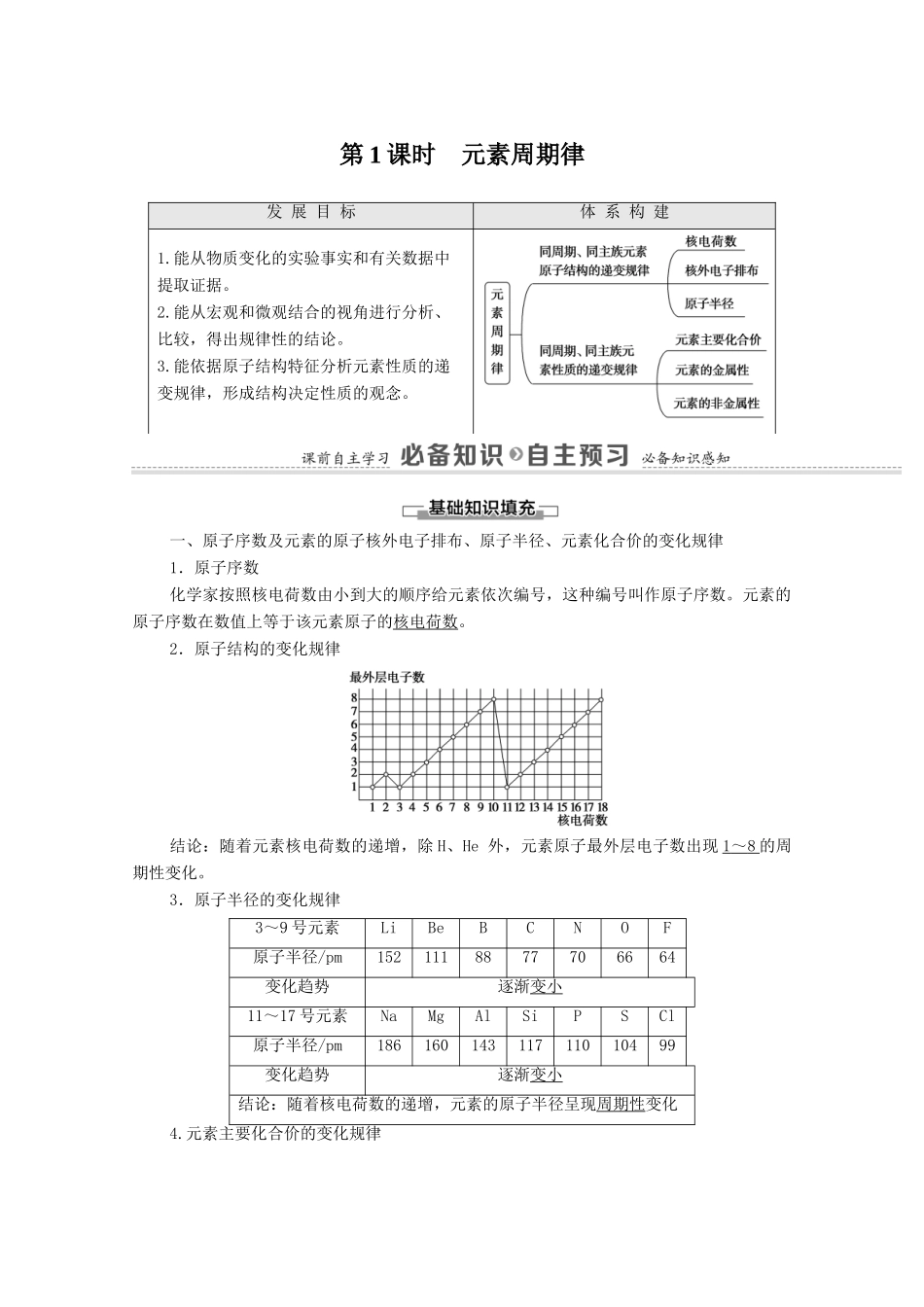
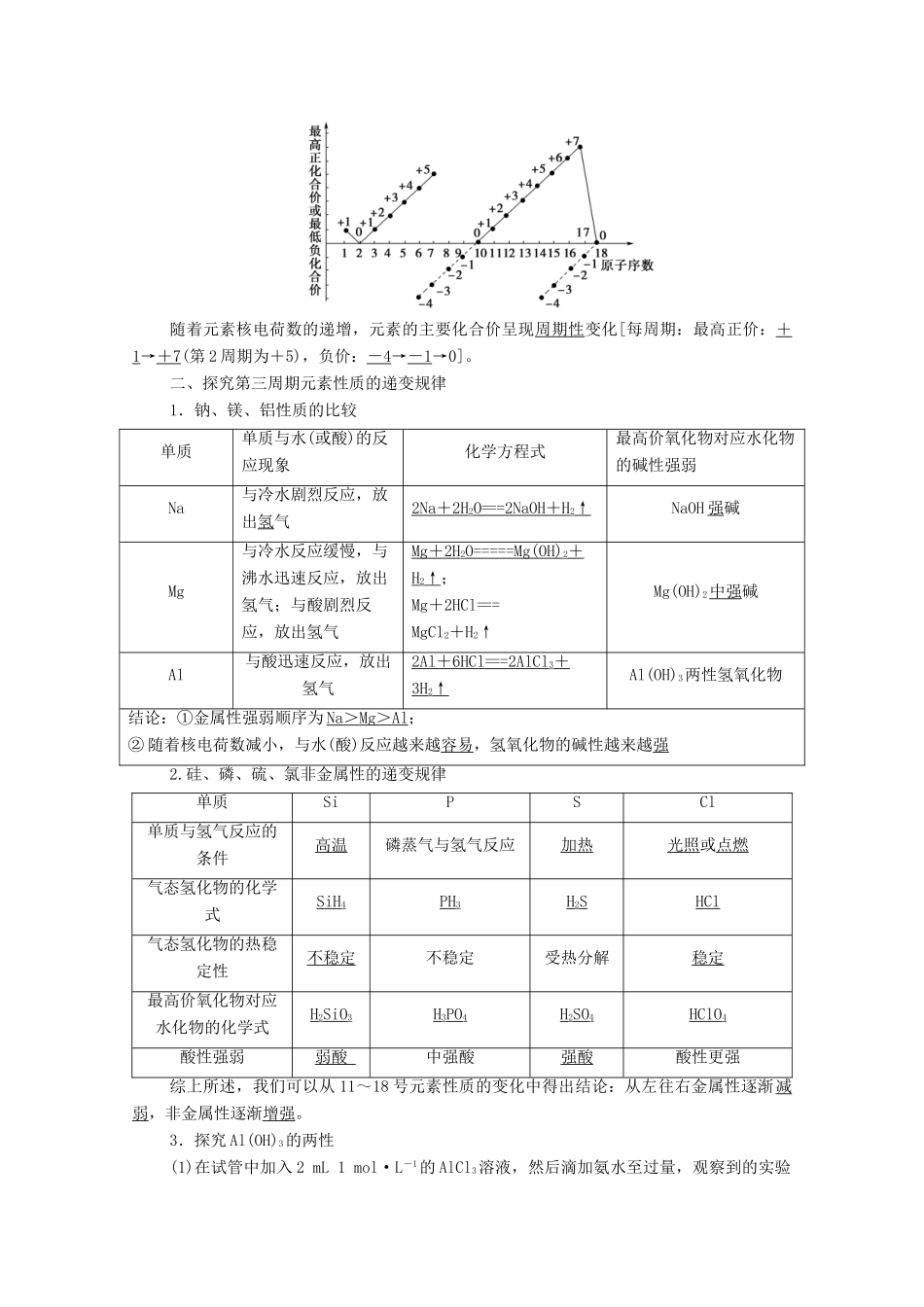
第 1 课时 元素周期律发 展 目 标体 系 构 建1.能从物质变化的实验事实和有关数据中提取证据。2.能从宏观和微观结合的视角进行分析、比较,得出规律性的结论。3.能依据原子结构特征分析元素性质的递变规律,形成结构决定性质的观念。一、原子序数及元素的原子核外电子排布、原子半径、元素化合价的变化规律1.原子序数化学家按照核电荷数由小到大的顺序给元素依次编号,这种编号叫作原子序数。元素的原子序数在数值上等于该元素原子的核电荷数。2.原子结构的变化规律结论:随着元素核电荷数的递增,除 H、He 外,元素原子最外层电子数出现 1 ~ 8 的周期性变化。3.原子半径的变化规律3~9 号元素LiBeBCNOF原子半径/pm1521118877706664变化趋势逐渐变小11~17 号元素NaMgAlSiPSCl原子半径/pm18616014311711010499变化趋势逐渐变小结论:随着核电荷数的递增,元素的原子半径呈现周期性变化4.元素主要化合价的变化规律随着元素核电荷数的递增,元素的主要化合价呈现周期性变化[每周期:最高正价:+1→+ 7 (第 2 周期为+5),负价:- 4 →- 1 →0]。二、探究第三周期元素性质的递变规律1.钠、镁、铝性质的比较单质单质与水(或酸)的反应现象化学方程式最高价氧化物对应水化物的碱性强弱Na与冷水剧烈反应,放出氢气2Na + 2H 2O == = 2NaOH + H 2↑NaOH 强碱Mg与冷水反应缓慢,与沸水迅速反应,放出氢气;与酸剧烈反应,放出氢气Mg + 2H 2O ===== Mg(OH) 2+H2↑;Mg+2HCl===MgCl2+H2↑Mg(OH)2中强碱Al与酸迅速反应,放出氢气2Al + 6HCl == = 2AlCl 3+3H2↑Al(OH)3两性氢氧化物结论:①金属性强弱顺序为 Na > Mg > Al ;② 随着核电荷数减小,与水(酸)反应越来越容易,氢氧化物的碱性越来越强2.硅、磷、硫、氯非金属性的递变规律单质SiPSCl单质与氢气反应的条件高温磷蒸气与氢气反应加热光照或点燃气态氢化物的化学式SiH4PH3H2SHCl气态氢化物的热稳定性不稳定不稳定受热分解稳定最高价氧化物对应水化物的化学式H2SiO3H3PO4H2SO4HClO4酸性强弱弱酸 中强酸强酸酸性更强综上所述,我们可以从 11~18 号元素性质的变化中得出结论:从左往右金属性逐渐减弱,非金属性逐渐增强。3.探究 Al(OH)3的两性(1)在试管中加入 2 mL 1 mol·L-1的 AlCl3溶液,然后滴加氨水至过量,观察到的实验现象是产生白色胶状物质。反应的化学方程式是 AlCl3+ 3NH 3·H2O == = Al(OH) 3↓ ...