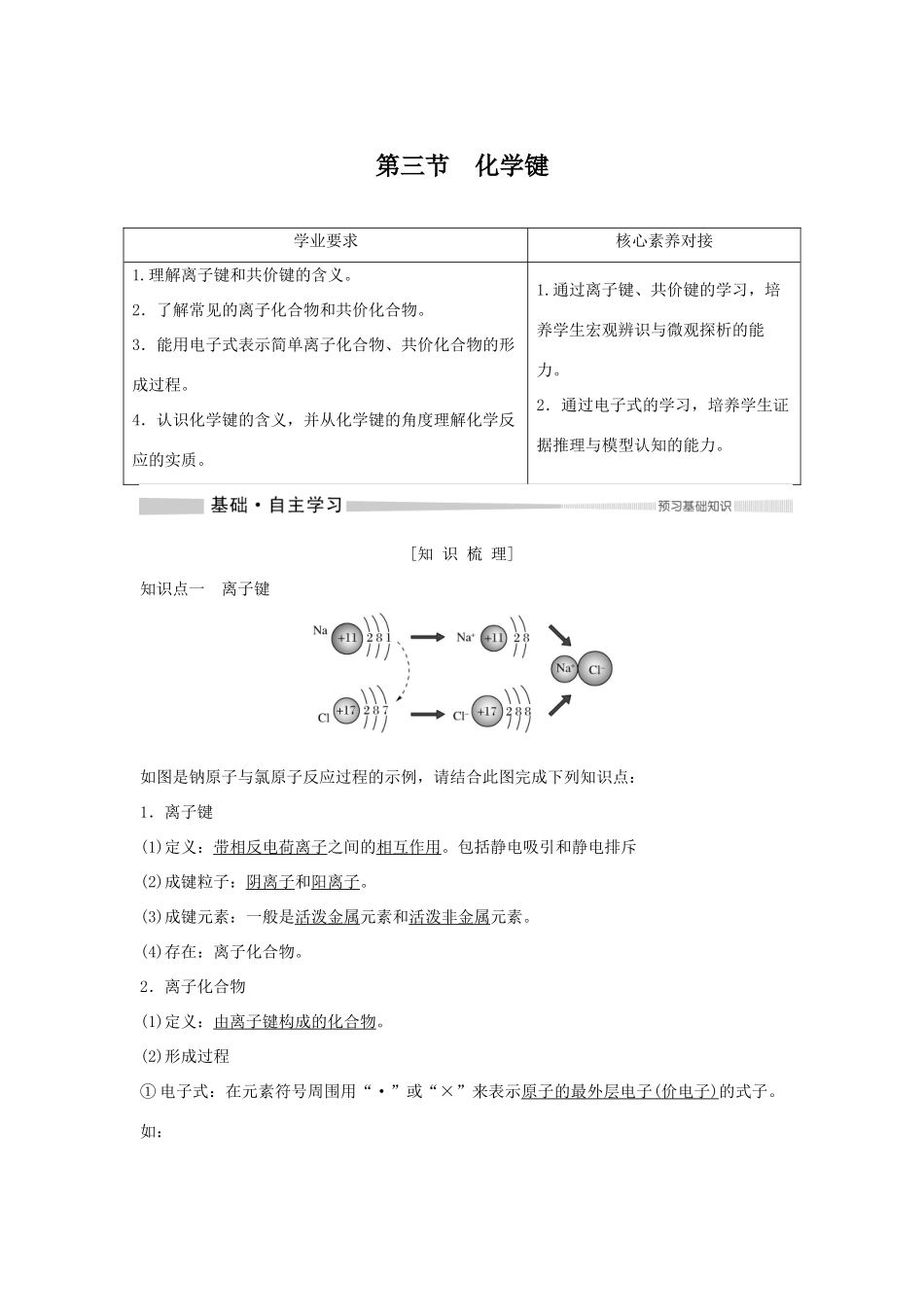
第三节化学键学业要求核心素养对接1.理解离子键和共价键的含义。2.了解常见的离子化合物和共价化合物。3.能用电子式表示简单离子化合物、共价化合物的形成过程。4.认识化学键的含义,并从化学键的角度理解化学反应的实质。1.通过离子键、共价键的学习,培养学生宏观辨识与微观探析的能力。2.通过电子式的学习,培养学生证据推理与模型认知的能力。[知识梳理]知识点一离子键如图是钠原子与氯原子反应过程的示例,请结合此图完成下列知识点:1.离子键(1)定义:带相反电荷离子之间的相互作用。包括静电吸引和静电排斥(2)成键粒子:阴离子和阳离子。(3)成键元素:一般是活泼金属元素和活泼非金属元素。(4)存在:离子化合物。2.离子化合物(1)定义:由离子键构成的化合物。(2)形成过程①电子式:在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)的式子。如:原子:Na:、Mg:、Cl:、S:;阳离子:Na+:Na+、Mg2+:Mg2+;阴离子:Cl-:、S2-:。②形成过程:。知识点二共价键如图是氢原子与氯原子形成氯化氢分子的示意图,请结合此图完成下列知识点:1.共价键(1)定义:原子间通过共用电子对所形成的相互作用。(2)成键粒子:原子。(3)成键元素:同种或不同种非金属元素化合时能形成共价键。(4)存在:①非金属单质(除稀有气体),如H2、O2、N2、O3。②共价化合物,如CO2、HCl、H2SO4、SiO2。③某些离子化合物,如NaOH、Na2O2、Na2CO3、NH4Cl。(5)分类:(6)表示:①电子式:如HCl:、H2:H∶H、H2O:;②结构式:如N2:N≡N、HCl:H—Cl、CO2:O===C===O。2.共价化合物(1)定义:以共用电子对形成的化合物。(2)形成过程:。HClO的电子式是,而不是;结构式是H—O—Cl,而不是H—Cl—O。知识点三化学键、分子间作用力和氢键1.化学键(1)概念:相邻的原子之间强烈的相互作用。(2)形成类别①原子间价电子的转移——离子键。完全失去②原子间价电子的共用——共价键。共用(3)化学反应的本质:化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。2.分子间作用力(1)定义:把分子聚集在一起的作用力叫做分子间作用力,又叫范德华力。(2)规律:一般说来,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也就越高,如卤素单质的熔、沸点:F2<Cl2<Br2<I2。3.氢键如液态NH3、H2O和HF中分子之间存在的一种比分子间作用力稍强的相互作用,叫做氢键。氢键不是化学键,可看作一种较强的分子间作用力。化学键既影响物质的物理性质,又影响物质的化学性质;而分子间作用力只影响物质的物理性质。微判断(1)任何物质中均含有化学键。()(2)含有金属元素的化合物一定是离子化合物。()(3)全部由非金属元素组成的化合物可能是离子化合物。()(4)由分子组成的物质中一定存在共价键。()(5)由非金属元素组成的化合物一定是共价化合物。()(6)离子化合物中一定不存在共价键。()(7)含有共价键的化合物一定是共价化合物。()(8)共价化合物中可能含有离子键。()(9)构成单质分子的粒子一定含有共价键。()(10)由非金属元素组成的化合物不一定是共价化合物。()(11)不同元素组成的多原子分子里的化学键一定是极性键。()答案(1)×(2)×(3)√(4)×(5)×(6)×(7)×(8)×(9)×(10)√(11)×微训练1.下列电子式或用电子式表示化合物形成过程正确的是()解析正确写法应为,A错误;氯原子最外层电子没写全,B错误;生成物中的2个要分开写在Mg2+的两侧,不能合并写,C错误;符合电子式的书写要求,D正确。答案D2.关于离子键、共价键的下列说法中正确的是()A.CaCl2中既有离子键又有共价键B.非极性键只存在于双原子的单质分子(如Cl2)中C.在共价化合物分子内,一定不存在离子键D.由多种元素组成的多原子分子里,一定只存在极性键解析CaCl2中无共价键,A项错误;非极性键存在于单质分子和化合物中,如H2O2中氧原子间为非极性键,B、D项错误;若有离子键,则属于离子化合物,共价化合物中一定无离子键,C项正确。答案C3.对于HCl、H2SO4、NaOH、NaCl、NH4Cl、Ne、N2、金刚石,回答下列问题:(1)不存在化学键的是______________________________。(2)属于共价化合...