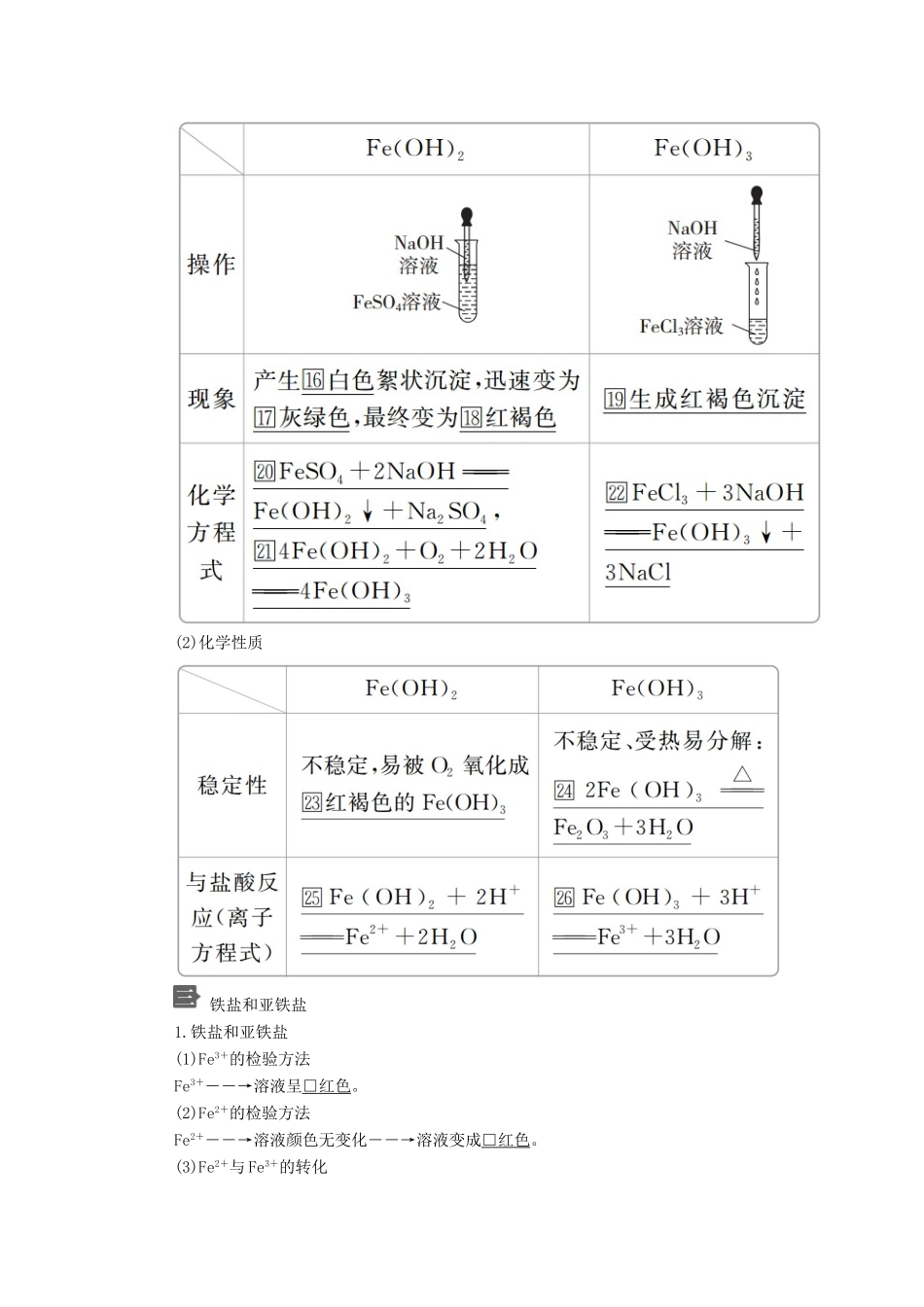
第一节铁及其化合物[明确学习目标]1.了解单质铁的还原性,一定条件下能与非金属单质、酸和某些盐反应,初步学会根据铁与水蒸气反应的原理设计实验装置。2.了解铁的重要化合物的主要性质及应用。3.掌握Fe2+、Fe3+的检验方法及其相互转化。4.了解Fe(OH)2、Fe(OH)3的制备方法。学生自主学习铁的单质1.铁在地壳中含量仅次于□氧、□硅和□铝,居第□四位,主要以□+2价和□+3价化合物形式存在。2.铁单质的性质(1)物理性质:银白色金属,导电、导热性好,能被磁铁吸引。(2)化学性质(写出反应的化学方程式)①与Cl2反应:□2Fe+3Cl2=====2FeCl3。②与O2反应:□3Fe+2O2=====Fe3O4。③与稀H2SO4反应:□Fe+H2SO4===FeSO4+H2↑。④与CuSO4溶液反应:□Fe+CuSO4===FeSO4+Cu。(3)铁与水蒸气反应的实验探究铁的氧化物和氢氧化物1.铁的氧化物2.铁的氢氧化物(1)铁的氢氧化物的制备(2)化学性质铁盐和亚铁盐1.铁盐和亚铁盐(1)Fe3+的检验方法Fe3+――→溶液呈□红色。(2)Fe2+的检验方法Fe2+――→溶液颜色无变化――→溶液变成□红色。(3)Fe2+与Fe3+的转化①实验及现象溶液颜色变化:由黄色→□浅绿色→□无明显变化→□红色。②反应的离子方程式□2Fe3++Fe===3Fe2+,□2Fe2++Cl2===2Fe3++2Cl-。③结论Fe3+((((Fe2+。1.怎么除去FeCl2溶液中的少量Fe3+?从中你得出一个什么样的结论?提示:加足量的铁粉振荡、静置、过滤,其反应的离子方程式为:2Fe3++Fe===3Fe2+。由此可知:含同一元素的不同价态的物质反应时,生成含该元素中间价态的物质,如:C+CO2=====2CO。2.Fe(OH)2很容易被空气中的氧气氧化,在制备Fe(OH)2时应如何防止Fe(OH)2被氧化?提示:①隔绝空气;②排除溶液中溶解的O2。3.除了上述检验Fe2+、Fe3+的方法外,你还知道其他区别二者的方法吗?提示:①观察法4.如何证明含有Fe3+的溶液中是否含有Fe2+?提示:由于溶液中含有Fe3+,利用NaOH溶液或KSCN溶液都无法证明溶液中是否含有Fe2+,可以利用Fe2+的还原性,向溶液中加入酸性KMnO4溶液,溶液紫色褪去证明溶液中含有Fe2+。课堂互动探究知识点一铁的单质(1)铁位于金属活动性顺序表中氢原子之前,因此可以与酸反应置换出H2,生成Fe2+。(2)铁在纯氧中燃烧、铁在高温下与水蒸气反应生成的是Fe3O4,Fe3O4中有2个+3价铁和一个+2价铁。1下列有关铁与水反应的说法中正确的是()A.在任何条件下,铁与水均能发生反应B.在高温时,铁与水蒸气反应生成氢氧化铁和氢气C.在高温时,铁与水蒸气反应生成氧化铁和氢气D.在高温时,铁与水蒸气反应生成四氧化三铁和氢气[批注点拨][解析]高温时,铁与水蒸气反应生成Fe3O4和H2。[答案]D[练1]一定条件下,等量的铁分别与足量的盐酸、水蒸气充分反应,则在相同的条件下产生氢气的体积比是()A.1∶1B.4∶3C.2∶3D.3∶4答案D解析根据Fe+2HCl===FeCl2+H2↑、3Fe+4H2O(g)=====Fe3O4+4H2可知,1molFe与足量盐酸反应生成1molH2,1molFe与足量水蒸气反应生成molH2,故相同条件下产生H2的体积比是3∶4。[练2]铁是一种化学性质比较活泼的金属,在一定条件下能与多种物质发生化学反应。试仿照图中实例在方框内填写物质的化学式并书写化学方程式(要求:所填写的反应物不属于同一类物质,生成物必须填写铁的化合物)。(1)反应①的化学方程式为:___________。(2)反应②的化学方程式为:_________。(3)反应③的化学方程式为:________。答案A.H2OB.Fe3O4C.HClD.FeCl2E.CuSO4F.FeSO4(答案合理即可)(1)3Fe+4H2O(g)=====Fe3O4+4H2(2)Fe+2HCl===FeCl2+H2↑(3)Fe+CuSO4===FeSO4+Cu解析金属铁可以与非金属单质(O2等)、水蒸气、酸(盐酸、硫酸等)以及盐(CuSO4、AgNO3等)发生反应。方法规律单质铁与强氧化剂生成+3价铁的化合物;与弱氧化剂生成+2价铁的化合物。知识点二铁的氧化物和氢氧化物1.铁的氧化物都是不溶于水的化合物,其中FeO在空气中加热能迅速转化为具有磁性的化合物Fe3O4;FeO、Fe2O3都是碱性氧化物;FeO、Fe2O3、Fe3O4都能与酸反应,也都能与H2、CO等反应(表现其氧化性),如工业上利用Fe2O3、Fe3O4与CO反应制备重要的金属材料铁。2.制备Fe(OH)2的注意事项(1)Fe2+...