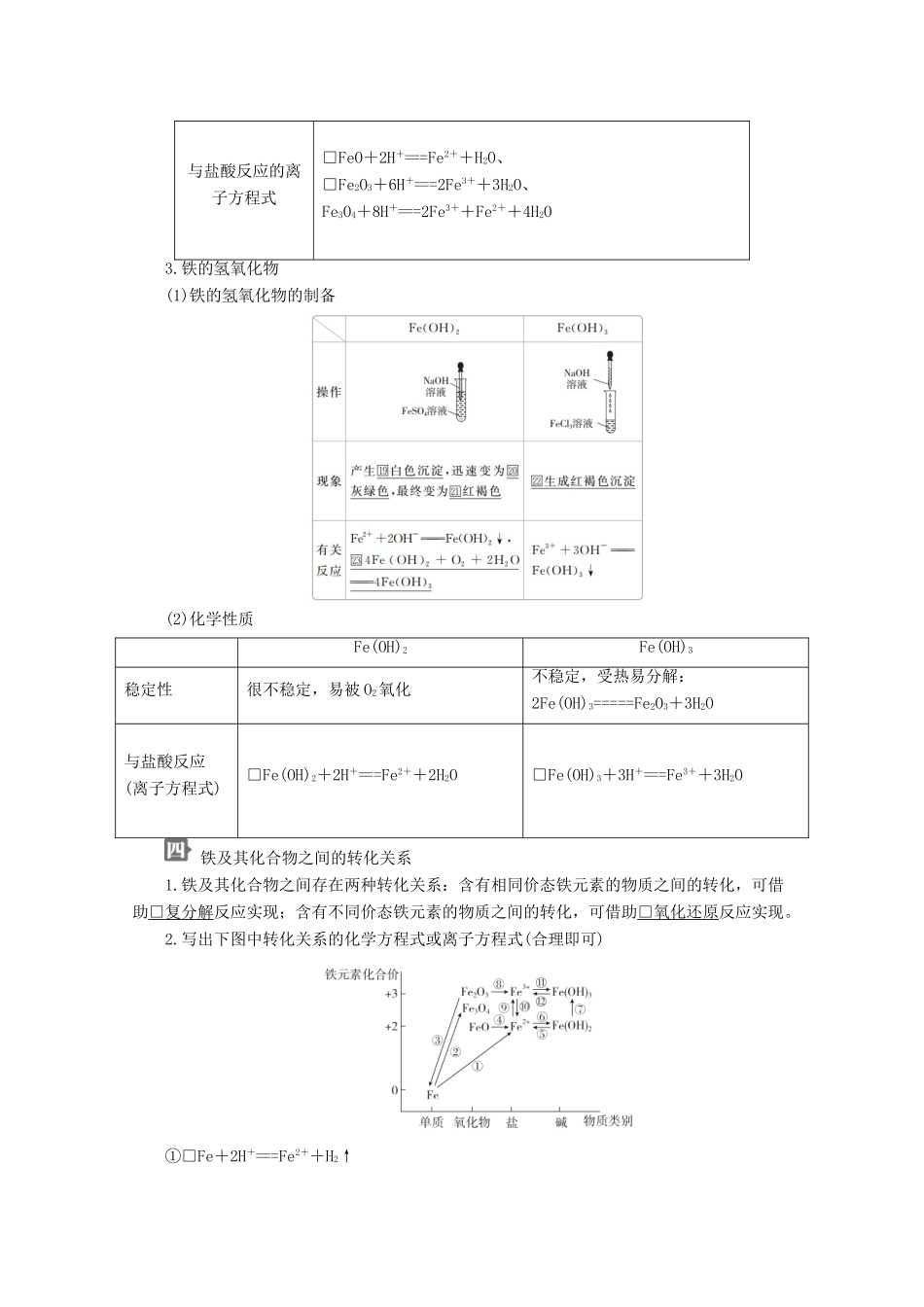
第1节铁的多样性核心素养发展重点学业要求1.依据核心元素的化合价推断物质的氧化性或还原性。2.通过反应实现物质转化,提出有依据的假设,选取试剂,设计实验方案并实施,基于实验事实得出结论。1.能辨识Fe、FeCl2、FeCl3等含铁元素的物质的重要的物理性质和化学性质及其实验现象,并能用化学方程式、离子方程式正确表示典型物质的主要化学性质。2.能从元素化合价的角度、依据氧化还原反应原理预测铁及其化合物的性质及其物质间的转化,设计实验进行验证,并能分析、解释有关现象。3.能利用铁及其化合物的性质和转化关系,设计制备、分离、检验等简单任务的方案,并分析科学实验、生产、生活中的某些常见问题,说明妥善保存、合理使用化学品的常见方法。自主学习铁元素的存在1.含量铁元素在地壳中的含量仅次于□氧、□硅和□铝。2.存在形态(1)游离态:存在于□陨铁中。(2)化合态:主要以□+2价和□+3价的化合物存在。如黄铁矿(主要成分是□FeS2)、赤铁矿(主要成分是□Fe2O3)、磁铁矿(主要成分是□Fe3O4)等。(3)日常生活用品中也有许多含有铁元素的物质,例如补铁的保健品中含有□亚铁盐,红色涂料中含有□三氧化二铁,激光打印机的墨粉中含有□四氧化三铁。亚铁盐和铁盐1.Fe3+的氧化性2.Fe2+的氧化性与还原性其他含有铁元素的物质1.铁与水蒸气的反应续表方法一方法二实验现象用小试管收集一试管气体,点燃,听到轻微的“噗”声,证明生成了□H2用火柴点燃肥皂泡,听到爆鸣声,证明生成了□H2实验结论铁不能与冷水、热水反应,但在高温条件下能与□水蒸气反应,化学方程式为□3Fe+4H2O(g)=====Fe3O4+4H22.铁的氧化物名称氧化亚铁氧化铁四氧化三铁化学式□FeO□Fe2O3□Fe3O4铁的化合价□+2□+3□+2、+3颜色□黑色□红棕色□黑色溶解性□不溶于水氧化物类别□碱性氧化物□碱性氧化物复杂氧化物与盐酸反应的离子方程式□FeO+2H+===Fe2++H2O、□Fe2O3+6H+===2Fe3++3H2O、Fe3O4+8H+===2Fe3++Fe2++4H2O3.铁的氢氧化物(1)铁的氢氧化物的制备(2)化学性质Fe(OH)2Fe(OH)3稳定性很不稳定,易被O2氧化不稳定,受热易分解:2Fe(OH)3=====Fe2O3+3H2O与盐酸反应(离子方程式)□Fe(OH)2+2H+===Fe2++2H2O□Fe(OH)3+3H+===Fe3++3H2O铁及其化合物之间的转化关系1.铁及其化合物之间存在两种转化关系:含有相同价态铁元素的物质之间的转化,可借助□复分解反应实现;含有不同价态铁元素的物质之间的转化,可借助□氧化还原反应实现。2.写出下图中转化关系的化学方程式或离子方程式(合理即可)①□Fe+2H+===Fe2++H2↑②□3Fe+2O2=====Fe3O4③□Fe2O3+3CO=====2Fe+3CO2④□FeO+2H+===Fe2++H2O⑤□Fe(OH)2+2H+===Fe2++2H2O⑥□Fe2++2OH-===Fe(OH)2↓⑦□4Fe(OH)2+O2+2H2O===4Fe(OH)3⑧□Fe2O3+6H+===2Fe3++3H2O⑨□2Fe2++Cl2===2Fe3++2Cl-⑩□2Fe3++Cu===2Fe2++Cu2+⑪□Fe3++3OH-===Fe(OH)3↓⑫□Fe(OH)3+3H+===Fe3++3H2O课堂探究一、亚铁盐和铁盐某同学检验某工业矿渣FeO中是否含Fe2O3时的步骤为:取矿渣样品――→取上层清液于试管中――→溶液变为红色―→结论,该矿渣中含Fe2O3,其结论是否正确?为什么?提示:该同学的结论不一定正确。因为HNO3能与FeO反应生成Fe(NO3)3,故该同学结论不一定正确。1.Fe3+和Fe2+的检验2.检验Fe2+溶液中是否含Fe3+的方法是:取待测液少许于试管中,向待测液中滴加KSCN溶液,若溶液变红色,证明含Fe3+。3.检验Fe3+溶液中是否含Fe2+的方法是:取待测液1~2mL于试管中,然后滴加几滴KMnO4(H+)溶液,若紫色褪去,证明含Fe2+。知识拓展在浓度相差不大的溶液中,同时含几种还原剂(如某溶液中含有Fe2+、Br-、I-)时,若加入一种氧化剂(如通入Cl2),则它首先与溶液中还原性最强的(I-)反应,然后与还原性较强的反应(即当I-反应完全后,再与Fe2+反应);同理含几种氧化剂时,所加还原剂先与氧化性最强的氧化剂反应。几种常见微粒的氧化性和还原性强弱顺序:氧化性:MnO(H+)>Cl2>Br2>Fe3+>I2还原性:I->Fe2+>Br->Cl->Mn2+1.铁的化合物常见的有①FeO、②Fe2O3、③Fe3O4、④F...