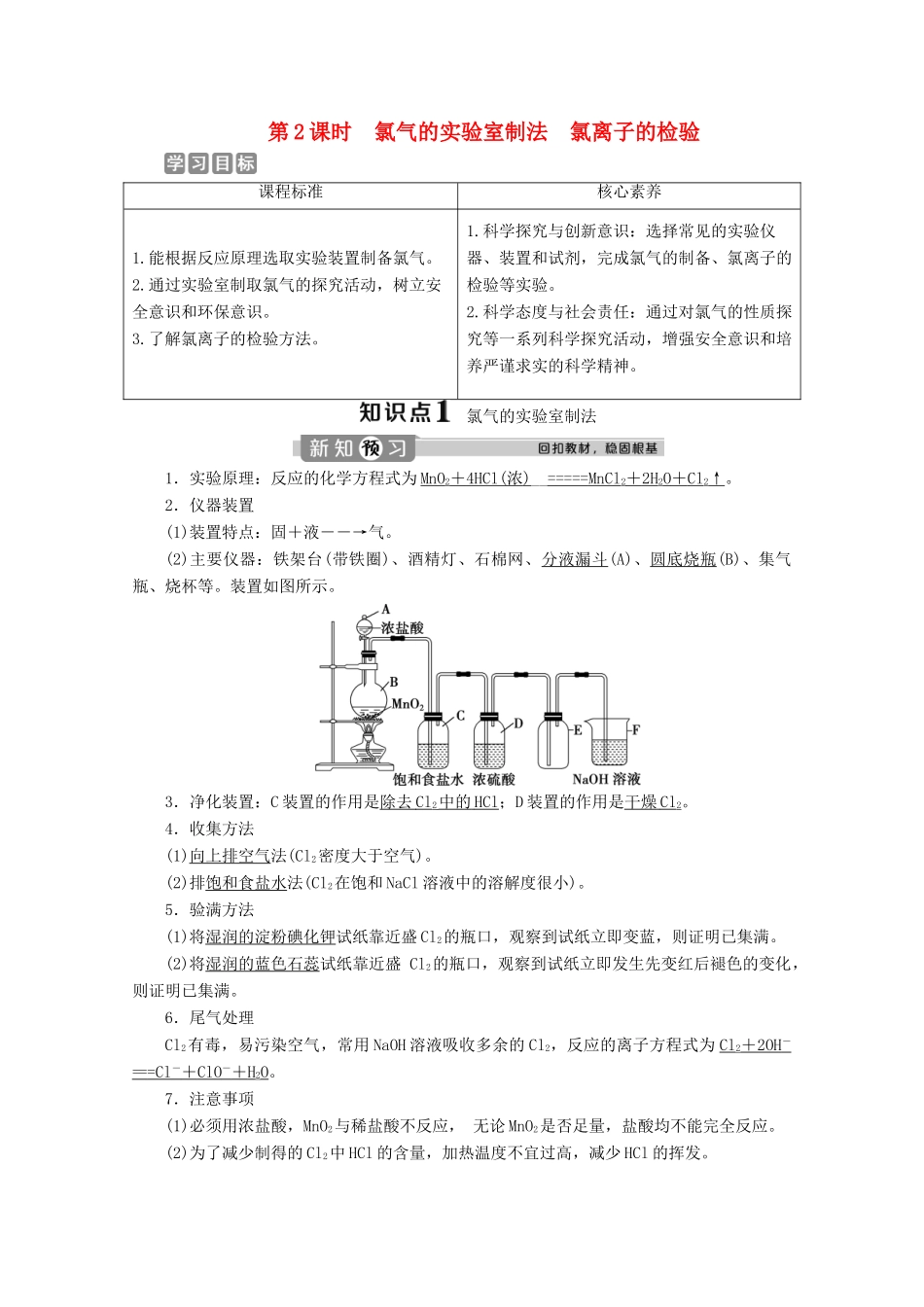
第2课时氯气的实验室制法氯离子的检验课程标准核心素养1.能根据反应原理选取实验装置制备氯气。2.通过实验室制取氯气的探究活动,树立安全意识和环保意识。3.了解氯离子的检验方法。1.科学探究与创新意识:选择常见的实验仪器、装置和试剂,完成氯气的制备、氯离子的检验等实验。2.科学态度与社会责任:通过对氯气的性质探究等一系列科学探究活动,增强安全意识和培养严谨求实的科学精神。氯气的实验室制法1.实验原理:反应的化学方程式为MnO2+4HCl(浓)__=====MnCl2+2H2O+Cl2↑。2.仪器装置(1)装置特点:固+液――→气。(2)主要仪器:铁架台(带铁圈)、酒精灯、石棉网、分液漏斗(A)、圆底烧瓶(B)、集气瓶、烧杯等。装置如图所示。3.净化装置:C装置的作用是除去Cl2中的HCl;D装置的作用是干燥Cl2。4.收集方法(1)向上排空气法(Cl2密度大于空气)。(2)排饱和食盐水法(Cl2在饱和NaCl溶液中的溶解度很小)。5.验满方法(1)将湿润的淀粉碘化钾试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满。(2)将湿润的蓝色石蕊试纸靠近盛Cl2的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。6.尾气处理Cl2有毒,易污染空气,常用NaOH溶液吸收多余的Cl2,反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。7.注意事项(1)必须用浓盐酸,MnO2与稀盐酸不反应,无论MnO2是否足量,盐酸均不能完全反应。(2)为了减少制得的Cl2中HCl的含量,加热温度不宜过高,减少HCl的挥发。(3)实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气。(4)尾气吸收时,不能用澄清石灰水吸收Cl2,因为澄清石灰水中Ca(OH)2浓度小,吸收不完全。实验室制取气体装置的设计1.气体制备、除杂、收集、尾气处理等装置的选择(1)依据反应物的状态和反应条件→气体的发生装置。(2)依据气体及其所含杂质的性质→除杂装置。(3)依据气体的密度、气体在水中的溶解性,以及是否与水反应→收集装置。(4)依据气体的性质→尾气处理装置。2.制取气体装置的一般连接顺序发生装置→除杂装置(如需要)→收集装置→尾气处理装置(如需要)。1.下列关于实验室用MnO2制取Cl2的叙述不正确的是()A.MnO2与浓盐酸共热B.缓慢加热反应C.用向下排空气法收集Cl2D.多余的Cl2常用较浓的碱液吸收解析:选C。由于浓HCl易挥发,故必须缓慢加热以减少HCl的挥发;Cl2的密度比空气的密度大,故应用向上排空气法收集Cl2;Cl2极易与碱反应:Cl2+2NaOH===NaCl+NaClO+H2O,故应用较浓的碱液吸收多余的Cl2。2.下列实验装置能达到实验目的或实验效果的是()ABCD收集氯气除去氯气中少量的氯化氢证明氯气具有漂白性吸收制备氯气时的尾气解析:选D。A.氯气密度大于空气,应采用向上排空气法收集,则导气管采用“长进短出”,故A错误;B.HCl极易溶于水,氯气也能溶于水,应该用饱和食盐水洗气法除去氯气中的HCl,故B错误;C.氯气没有漂白性,次氯酸有漂白性,该实验不能证明氯气有漂白性,故C错误;D.氯气能和碱性物质反应,可以用NaOH溶液吸收氯气,故D正确。3.如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是()A.a—b—c—d—e—f—g—hB.a—e—d—c—b—h—i—gC.a—d—e—c—b—h—i—gD.a—c—b—d—e—h—i—f解析:选B。按制气→除HCl→除H2O→制备FeCl3→吸收Cl2顺序连接。氯离子的检验1.实验探究:在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象,再分别加入少量稀硝酸,观察现象,填写下表:实验现象滴入几滴AgNO3溶液加入少量稀硝酸稀盐酸有白色沉淀生成沉淀不溶解NaCl溶液有白色沉淀生成沉淀不溶解Na2CO3溶液有白色沉淀生成沉淀溶解,有气泡产生2.实验结论:检验Cl-常用AgNO3溶液,一般先在待检液中滴入适量稀硝酸酸化,排除CO的干扰,然后滴入AgNO3溶液,如产生白色沉淀,则可判断该溶液中含有Cl-。1.自来水厂常用氯气对生活用水进行杀菌、消毒。市场上有些不法商贩为牟取暴利,用这样的自来水冒充纯净水(离子的浓度非常低)出售,给人们的生活造成了一定的不良影响。在下列化学试剂中,可以用于鉴别这种自来水和纯净水的是()A....