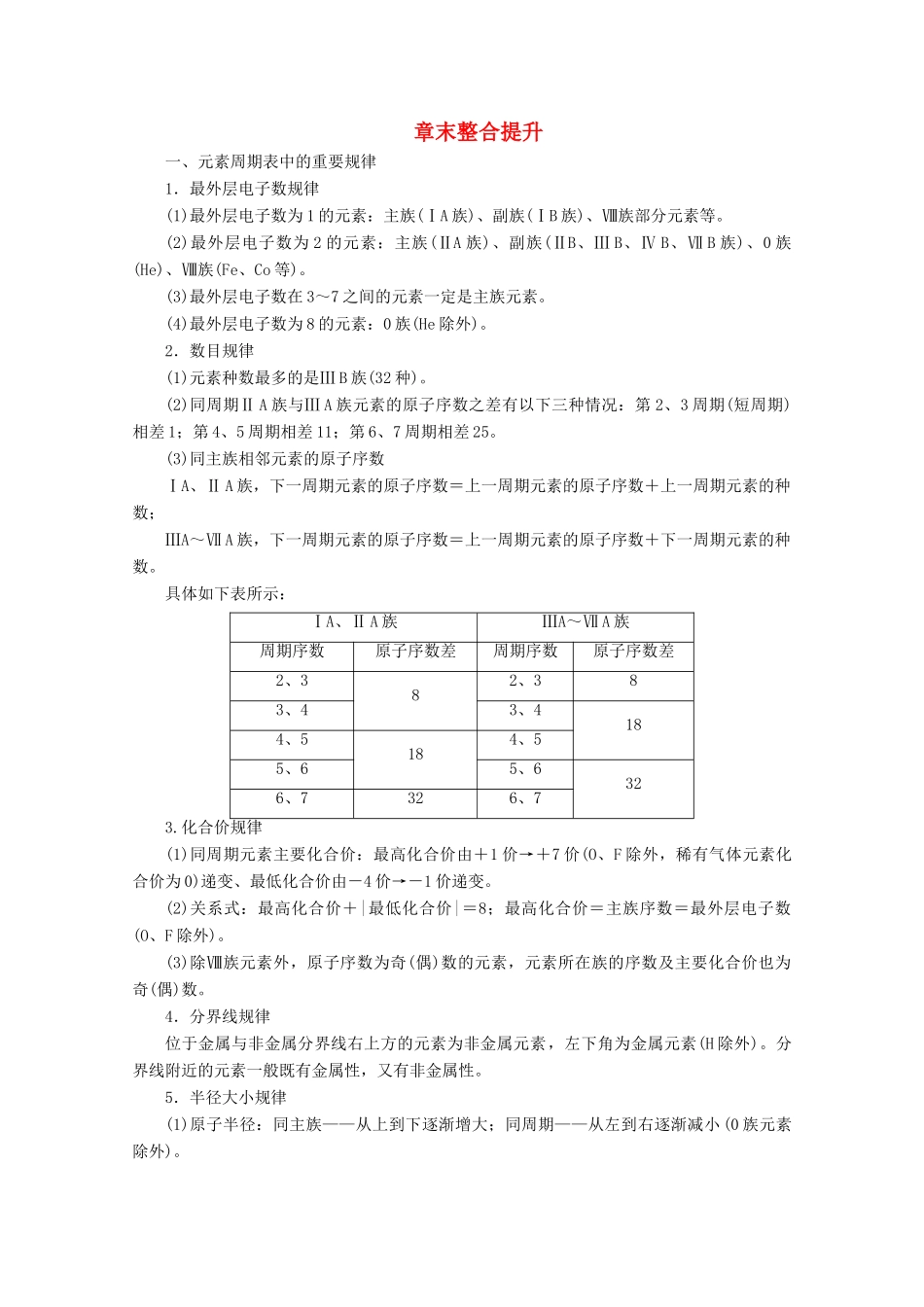
章末整合提升一、元素周期表中的重要规律1.最外层电子数规律(1)最外层电子数为1的元素:主族(ⅠA族)、副族(ⅠB族)、Ⅷ族部分元素等。(2)最外层电子数为2的元素:主族(ⅡA族)、副族(ⅡB、ⅢB、ⅣB、ⅦB族)、0族(He)、Ⅷ族(Fe、Co等)。(3)最外层电子数在3~7之间的元素一定是主族元素。(4)最外层电子数为8的元素:0族(He除外)。2.数目规律(1)元素种数最多的是ⅢB族(32种)。(2)同周期ⅡA族与ⅢA族元素的原子序数之差有以下三种情况:第2、3周期(短周期)相差1;第4、5周期相差11;第6、7周期相差25。(3)同主族相邻元素的原子序数ⅠA、ⅡA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的种数;ⅢA~ⅦA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的种数。具体如下表所示:ⅠA、ⅡA族ⅢA~ⅦA族周期序数原子序数差周期序数原子序数差2、382、383、43、4184、5184、55、65、6326、7326、73.化合价规律(1)同周期元素主要化合价:最高化合价由+1价→+7价(O、F除外,稀有气体元素化合价为0)递变、最低化合价由-4价→-1价递变。(2)关系式:最高化合价+|最低化合价|=8;最高化合价=主族序数=最外层电子数(O、F除外)。(3)除Ⅷ族元素外,原子序数为奇(偶)数的元素,元素所在族的序数及主要化合价也为奇(偶)数。4.分界线规律位于金属与非金属分界线右上方的元素为非金属元素,左下角为金属元素(H除外)。分界线附近的元素一般既有金属性,又有非金属性。5.半径大小规律(1)原子半径:同主族——从上到下逐渐增大;同周期——从左到右逐渐减小(0族元素除外)。(2)离子半径:同主族——同价离子从上到下逐渐增大;同周期——阴离子半径大于阳离子半径;具有相同电子层结构的离子——核电荷数越大,离子半径越小。(3)同种元素的各种微粒,核外电子数越多,半径越大;核外电子数越少,半径越小。【针对训练】1.2019年是门捷列夫发现元素周期律150周年。如表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是()A.原子半径:W<XB.常温常压下,Y单质为固态C.气态氢化物热稳定性:Z<WD.X的最高价氧化物的水化物是强碱解析:选D。由题中信息和图示可知W位于第2周期,X、Y、Z位于第3周期,结合W与X的最高化合价之和为8,且族序数相差2,可知X为Al,W和Z分别为N和P,Y为Si。原子半径:N