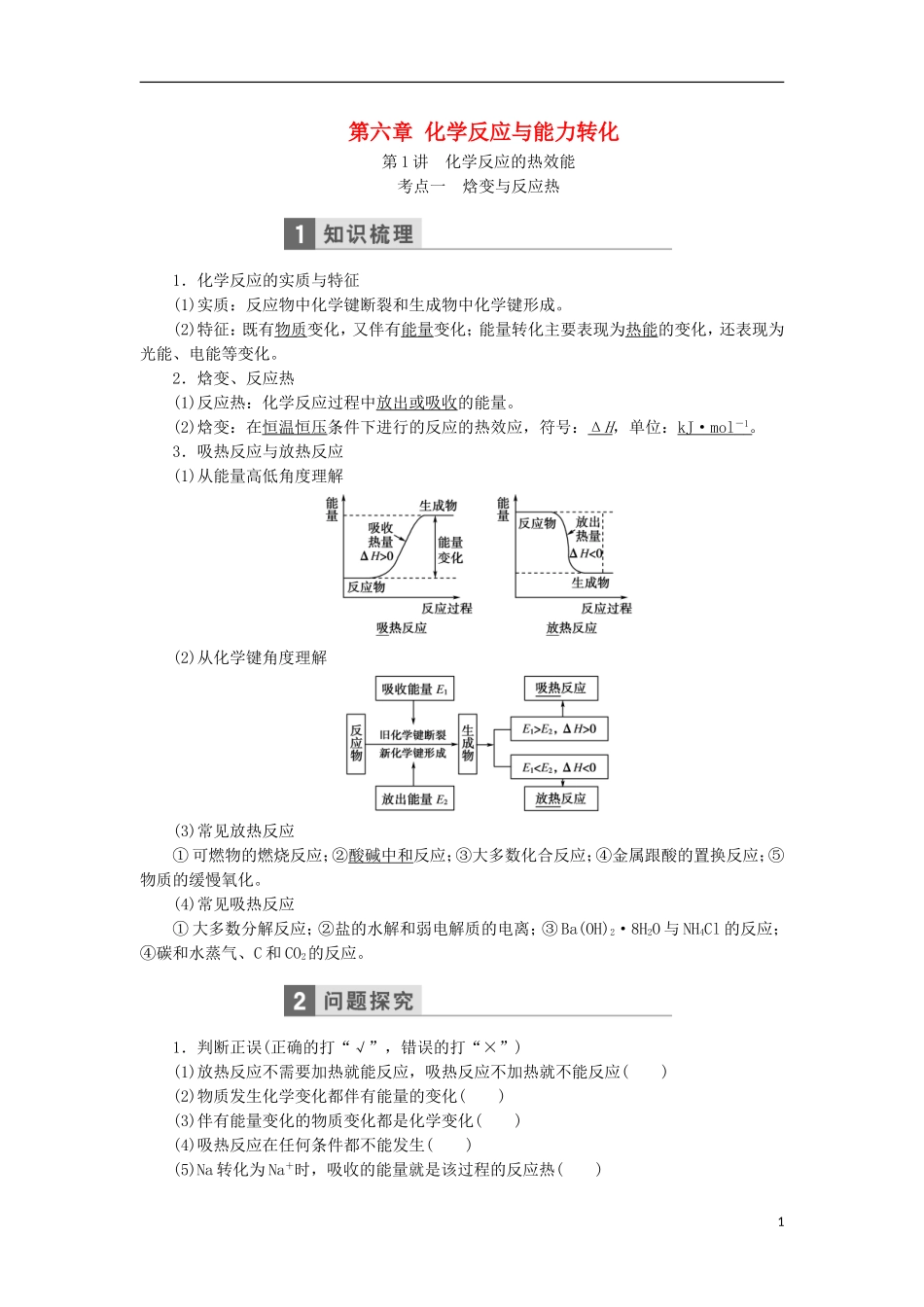
第六章 化学反应与能力转化第 1 讲 化学反应的热效能考点一 焓变与反应热1.化学反应的实质与特征(1)实质:反应物中化学键断裂和生成物中化学键形成。(2)特征:既有物质变化,又伴有能量变化;能量转化主要表现为热能的变化,还表现为光能、电能等变化。2.焓变、反应热(1)反应热:化学反应过程中放出或吸收的能量。(2)焓变:在恒温恒压条件下进行的反应的热效应,符号:Δ H ,单位:kJ·mol - 1 。3.吸热反应与放热反应(1)从能量高低角度理解(2)从化学键角度理解(3)常见放热反应① 可燃物的燃烧反应;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化。(4)常见吸热反应① 大多数分解反应;②盐的水解和弱电解质的电离;③ Ba(OH)2·8H2O 与 NH4Cl 的反应;④碳和水蒸气、C 和 CO2的反应。1.判断正误(正确的打“√”,错误的打“×”)(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应( )(2)物质发生化学变化都伴有能量的变化( )(3)伴有能量变化的物质变化都是化学变化( )(4)吸热反应在任何条件都不能发生( )(5)Na 转化为 Na+时,吸收的能量就是该过程的反应热( )1(6)水蒸气变为液态水时放出的能量就是该变化的反应热( )(7)同温同压下,反应 H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的 ΔH 不同( )(8)可逆反应的 ΔH 表示完全反应时的热量变化,与反应是否可逆无关( )2.在相同条件下,同质量的硫粉在空气中燃烧和在纯氧中燃烧,哪一个放出的热量多,为什么?提示: 1.(1)× (2)√ (3)× (4)× (5)× (6)× (7)× (8)√2.在空气中燃烧放出的热量多,因在纯氧中燃烧火焰明亮,转化成的光能多,故放出的热量少。题组一 利用图象,理清活化能与反应热的关系1.某反应的反应过程中能量变化如图所示(图中 E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )A.该反应为放热反应B.催化剂能改变该反应的焓变C.催化剂能降低该反应的活化能D.逆反应的活化能大于正反应的活化能解析: 由题图可知,生成物的总能量高于反应物的总能量,故该反应为吸热反应;催化剂能降低该反应的活化能,但不能改变该反应的焓变;E1>E2,说明正反应的活化能大于逆反应的活化能。答案: C2.反应 A+B―→C(ΔH<0)分两步进行:① A+B―→X(ΔH>0);② X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )解析: A+B―→C 的 ΔH<0...