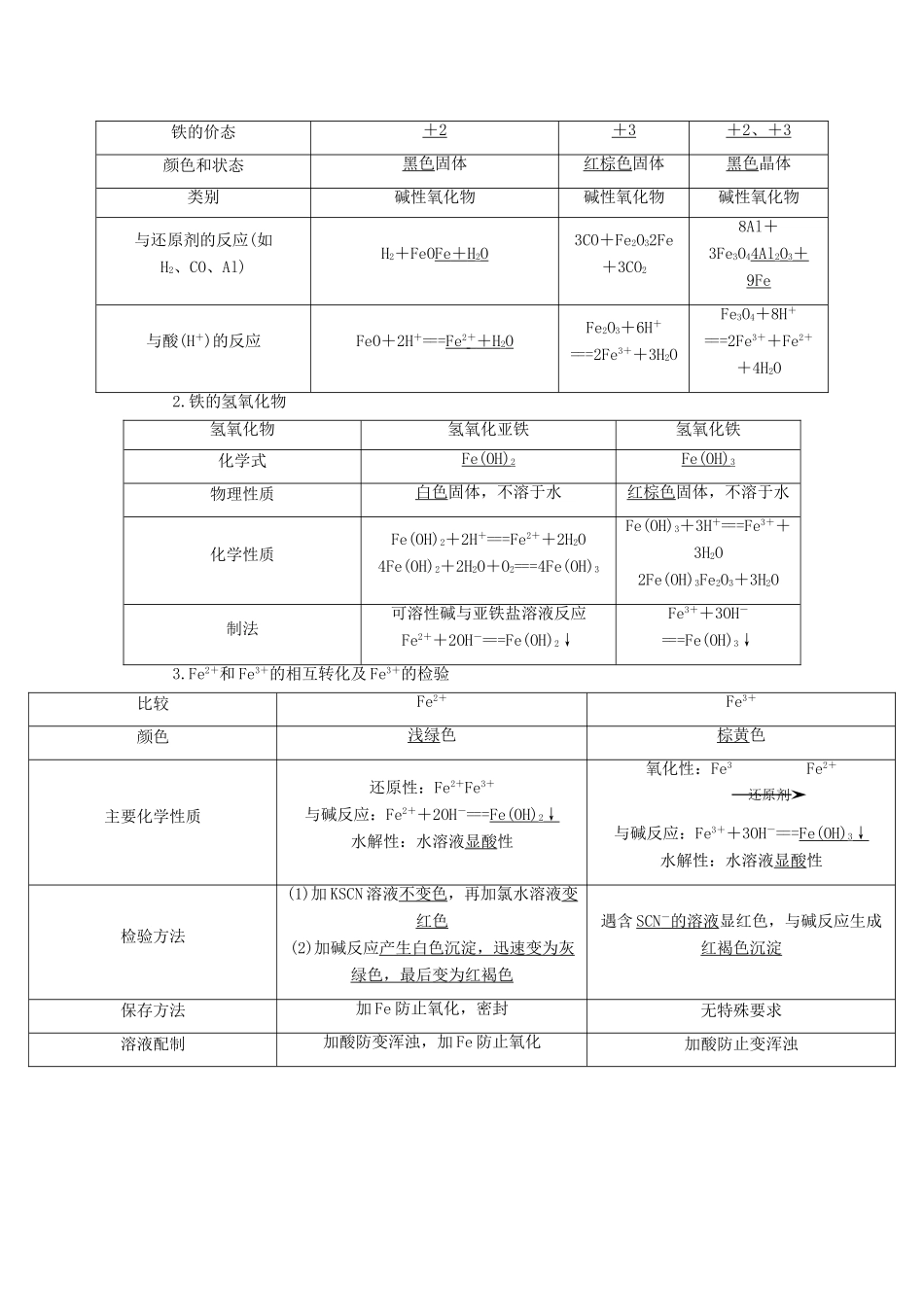
第 8 讲:铁、铜及其化合物【内容与解析】本节课要复习的内容是了解金属铁及其化合物的主要性质及应用。铁位于元素周期表中的第四周期,第Ⅷ族。Fe 的原子序数是 26,其原子结构示意图为。铁为变价金属,通常显+ 2 和+ 3 价【教学目标与解析】1.教学目标 (1)铁的原子结构特点 (2)铁的物理性质(2).铁的化学性质2.目标解析(1)铁的原子结构特点 就是指铁位于元素周期表中的第四周期,第Ⅷ族。Fe 的原子序数是 26,其原子结构示意图为。铁为变价金属,通常显+ 2 和+ 3 价。 (2)铁的物理性质就是指:纯净的铁是光亮的银白色金属,密度较大,熔、沸点较高,纯铁的抗腐蚀性强,有较好的导电、导热、延展性。铁能被磁铁吸引。(2).铁的化学性质就是指:(1)铁与非金属的反应(2)铁与水蒸气的反应(3)铁与酸反应(4)铁与盐溶液的反应【问题诊断分析】本节的复习学习是高中知识的重要组成部分,本节中难在铁的两性上,再就是铁热反应与铁的计算问题。其重点是化学方程式与离子方程式的书写。【复习过程】自主复习一、铁的结构和性质1.铁的原子结构和物理性质(1)铁的原子结构特点铁位于元素周期表中的第四周期,第Ⅷ族。Fe 的原子序数是 26,其原子结构示意图为。铁为变价金属,通常显+ 2 和+ 3 价。(2)铁的物理性质纯净的铁是光亮的银白色金属,密度较大,熔、沸点较高,纯铁的抗腐蚀性强,有较好的导电、导热、延展性。铁能被磁铁吸引。2.铁的化学性质(1)铁与非金属的反应① 铁和氯气的反应化学方程式:2Fe + 3Cl 22FeCl3。② 铁和氧气的反应实验步骤:把细铁丝在火柴杆上盘成螺旋状,点燃火柴,然后迅速伸入盛有 O2的集气瓶中,观察现象。实验现象:铁丝在 O2中剧烈燃烧,火星四射,生成黑色固体物质。化学方程式:3Fe + 2O 2Fe3O4。③ 铁和其他非金属的反应2Fe+3Br2===2FeBr3Fe+SFeS(黑色固体) Fe+I2FeI2(2)铁与水蒸气的反应实验步骤:在玻璃管中放入还原铁粉或石棉绒的混合物,加热,并通入水蒸气。用试管收集产生的经干燥的气体,并靠近火焰点火。观察现象。实验现象:红热的铁与水蒸气起反应,放出气体。用试管收集气体,将气体靠近火焰点火,能燃烧或发出爆鸣声。实验结论:3Fe + 4H 2O(g)Fe3O4+ 4H 2。(3)铁与酸反应① 铁与非氧化性酸(如稀 H2SO4、HCl 等)反应生成 Fe2+,放出 H2。离子方程式:Fe + 2H + == =Fe 2 + + H 2↑ 。 ② 铁与氧化性酸(如稀 HNO3)反应...